CorSalud 2015 Jul-Sep;7(3):217-226
ARTÍCULO DE REVISIÓN
ESTIMULACIÓN CARDÍACA EN PEDIATRÍA: ¿SIGUE SIENDO EL VENTRÍCULO DERECHO EL SITIO ÓPTIMO?
MSc. Dr. Michel Cabrera Ortegaa y Dra. Dunia B. Benítez Ramosb
______________
Departamento de Arritmia y Estimulación Cardíaca.
Servicio Clínico de Cardiología Pediátrica.
Cardiocentro Pediátrico William Soler. La Habana, Cuba.
Correspondencia: M. Cabrera Ortega. Calle 100 e/San Fco y Perla, Altahabana CP 10800. Boyeros, La Habana.
Correo
electrónico: michel@cardiows.sld.cu
Resumen
La estimulación cardíaca permanente se indica en pediatría, con mayor frecuencia, debido al bloqueo aurículo-ventricular. El ventrículo derecho ha sido tradicionalmente el sitio estimulado, dada la factibilidad del acceso, la estabilidad del electrodo y el mantenimiento de umbrales crónicos adecuados. Sin embargo, dicha estimulación se asocia a un patrón disincrónico de activación ventricular, que puede producir remodelado y deterioro de la función ventricular izquierda. En la población pediátrica, donde la estimulación se inicia muchas veces desde edades tempranas y con una larga expectativa de vida, constituye una premisa la preservación de la función cardíaca, por lo que la prevención de la disincronía mediante la utilización de sitios alternativos de estimulación, más que una prioridad, constituye un reto. El presente artículo tiene el objetivo de mostrar los efectos de la estimulación ventricular derecha, así como las evidencias demostradas del beneficio e implicaciones clínicas y prácticas de los sitios alternativos de estimulación en la población pediátrica.
Palabras clave: Estimulación ventricular, Pediatría, Disincronía, Función ventricular
Cardiac pacing in pediatrics: Is still the right ventricle the optimal pacing site?
Abstract
Permanent cardiac pacing is frequently indicated in pediatric patients due to atrioventricular block. Traditionally, the right ventricle has been the pacing site because it is readily accessible, and provides lead stability and optimal chronic pacing thresholds. However, it is associated with a dyssynchrony pattern of ventricular activation, that may cause remodeling and impairment of left ventricular function. In pediatric patients, paced from an early age and with a long life expectancy, the preservation of cardiac function is a premise. Therefore, the prevention of dyssynchrony, using possible alternative sites, is not just a priority, is a challenge. The aim of the article is to show the effects of chronic right ventricular pacing as well as the evidence of benefits provided by alternatives pacing sites in pediatric population and their clinical and practical implications.
Key words: Ventricular pacing, Pediatrics, Dyssynchrony, Ventricular function
Introducción
La indicación más frecuente de estimulación cardíaca eléctrica en pediatría es el bloqueo aurículo-ventricular completo (BAVC), congénito o adquirido. Al igual que en la población adulta, el ventrículo derecho (VD) ha sido tradicionalmente el sitio estimulado por el fácil acceso, la estabilidad del catéter-electrodo a largo plazo, así como el mantenimiento de umbrales crónicos adecuados. En dependencia de la edad del paciente y las preferencias de cada centro, el marcapaso es implantado por vía epicárdica preferentemente en la pared libre del VD, o por vía endocavitaria en el ápex del VD (AVD). Sin embargo, la estimulación desde dichos sitios induce un patrón de contracción disincrónica caracterizado por la activación precoz del VD y el septum interventricular, y una activación retardada de la pared lateral del ventrículo izquierdo (VI)1.
Este patrón produce una asincronía interventricular eléctrica y mecánica, así como asincronía intraventricular1. Aunque este deletéreo efecto es tolerado en la mayoría de los casos2,3, muchas investigaciones4-7 demuestran que la estimulación crónica desde el VD es un factor de riesgo importante para el deterioro agudo o crónico de la función ventricular izquierda, el remodelado estructural del VI y el incremento del riesgo de insuficiencia cardíaca (IC), lo cual se ha informado entre el 6-13 % de los pacientes pediátricos seguidos durante una década4,7-10.
Efectos de la estimulación ventricular derecha
Bajo circunstancias fisiológicas, la activación eléctrica de los miocitos ventriculares se inicia desde la región endocárdica del ápex y progresa hacia las zonas epicárdicas basales (Figura 1A), lo que produce una contracción mecánica coordinada, energéticamente eficiente, que garantiza un funcionamiento ventricular izquierdo óptimo. Durante esta secuencia normal de activación ventricular, se establece una sincronía entre ambas cámaras ventriculares (sincronía interventricular), y entre los diferentes segmentos de cada uno de los ventrículos (sincronía intraventricular).
La estimulación artificial, desde la pared libre y el AVD (Figura 1B), por su parte, produce cambios en el inicio, la secuencia de activación eléctrica y el patrón contráctil. Desde el sitio estimulado, se extiende una onda de despolarización que sufre un enlentecimiento de la conducción miocito-miocito en su expansión al resto del miocardio, lo que produce un patrón asincrónico de bloqueo de rama izquierda, caracterizado por la activación precoz de las miofibrillas cercanas al sitio de estimulación (VD y septum), con una despolarización retardada de las zonas más distantes (pared lateral del VI)11-13. Dicha asincronía causa que las regiones próximas al sitio estimulado «tiren» de las aún no activadas, lo que retrasa el acortamiento e incrementa la fuerza de contracción local por el mecanismo de Frank-Starling. De la misma forma, los territorios despolarizados de manera tardía suponen una carga para las regiones con activación precoz. El resultado final es una contracción menos efectiva y energéticamente menos eficiente, puesto que la contracción de las áreas despolarizadas tempranamente ocurre cuando aún las presiones del VI son bajas y no se ha iniciado la fase eyectiva, a lo cual se suma el consumo de la energía generada en dichas zonas por el efecto de «estiramiento» sobre las miofibrillas tardíamente activadas11. La contracción disincrónica, con la consiguiente redistribución asimétrica de la carga mecánica intraventricular, conduce también a la reducción regional de la perfusión y del consumo miocárdico de oxígeno13.
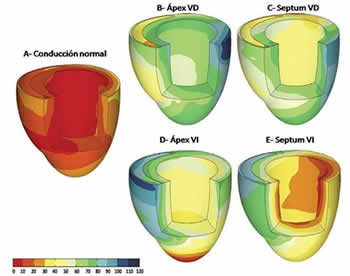
Figura 1. Mapa de activación eléctrica durante: A. Conducción normal, B. AVD, C. Zona septal del VD, D. AVI, E. Zona septal del VI. La barra de color refleja el tiempo de activación en milisegundos. Adaptada de Mills et al. Cir Arrhythmia Electrophysiol. 2009; 2:571-933, con permiso del autor.
El patrón de activación asincrónica compromete no solo la hemodinámica ventricular sino además la contractilidad, la relajación y por ende, el gasto cardíaco (Figura 2). La afectación de la función de bomba se expresa por la disminución de variables hemodinámicas, como el volumen y el trabajo sistólicos y un lento incremento de las presiones ventriculares izquierdas, a lo que se suma la desviación a la derecha de la curva presión telesistólica/volumen12. Asimismo, la pérdida de la interdependencia ventricular es determinante en el origen del movimiento paradójico del tabique que acompaña a la estimulación del VD; al iniciarse primero la contracción de la pared libre del VD, se establece entonces un gradiente de presión sistólica sobre el septum, con la consecuente pérdida de la contribución septal a la eyección ventricular izquierda. Por otra parte, el patrón de relajación anormal tiene su expresión en la disminución de la pendiente dP/dt, la velocidad de la onda E y el tiempo de llenado diastólico; estos cambios conducen a la prolongación de los tiempos de contracción y relajación isovolumétrica, lo que conlleva a una reducción de la precarga11-13.
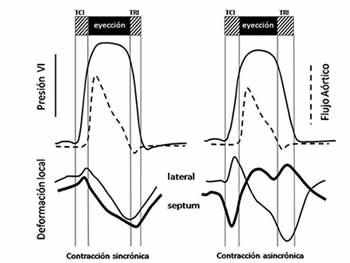
Figura 2. Efecto de la activación ventricular sincrónica y asincrónica sobre la presión de VI y la deformación regional. La contracción asincrónica produce movimiento paradójico del septum, lentos incrementos de las presiones ventriculares izquierdas con reducción del tiempo de eyección. Adaptada de Sweeney y Prinzen. Cir Arrhythm Electrophysiol. 2008; 1:127-3912, con permiso de los autores. TCI, tiempo de contracción isovolumétrica; TRI, tiempo de relajación isovolumétrica; VI, ventrículo izquierdo.
Disímiles son los efectos estructurales deletéreos que se han descrito a largo plazo14-16. Los hallazgos histopatológicos, observados en biopsias endomiocárdicas de las regiones medioseptales del VD14, muestran variaciones en el tamaño de las miofibrillas, presencia de depósitos de grasas, células de Purkinje prominentes, cambios morfológicos mitocondriales, así como áreas de calcificación, fibrosis, distrofias y esclerosis. Las alteraciones crónicas incluyen además modificaciones en el tono autonómico, remodelado anatómico de los ventrículos (dilatación e hipertrofia asimétrica)16, y alteraciones en los canales iónicos, una de cuyas expresiones es la variación del frente de repolarización ventricular, que puede persistir aún cuando haya cesado la estimulación (memoria electrotónica)17.
En la población adulta existen suficientes investigaciones11,16,18,19 que demuestran como la disincronía electromecánica conlleva al remodelado y a la disfunción asintomática del VI en el 50 % de los pacientes, con expresión clínica de insuficiencia ventricular izquierda en el 10 % de los casos. Varios son los factores identificados en esta población como desencadentes de la insuficiencia del VI, entre los que destacan: la asincronía, el remodelado adverso, la disincronía aurículo-ventricular izquierda y el desarrollo de una insuficiencia mitral funcional12.
La asincronía, como factor primordial, consta de tres elementos fundamentales: la dosis de asincronía, el tiempo y el sustrato relacionado a esta. Como medida evaluativa de la carga de disincronía ventricular se ha tomado el porcentaje de estimulación y la anchura del QRS estimulado (QRSe), de ahí que sea elevado el riesgo de IC a mayor porcentaje y anchura del QRSe11,20,21; de igual manera el riesgo se incrementa en los sujetos con trastornos de conducción intraventricular preexistentes y fracción de eyección del VI (FEVI) disminuida o limítrofe22-24. Sin embargo, los resultados y conclusiones de estos estudios20-24 en la población adulta no pueden ser extrapolados a la edad pediátrica por la diferencia en cuanto a la comorbilidad y las causas de disincronía e IC; de hecho, los resultados5,7-10,25-27 en este grupo etáreo son controversiales. Por un lado, Chiesa et al.10 informan una incidencia de IC de 8 % en niños estimulados desde el AVD, que se manifiesta a una edad media del primo-implante de solo 3 años; estos autores10 concluyen que un porcentaje de 100 % de estimulación ventricular y la presencia de QRSe ancho son predictores de riesgo. Por otra parte, Kim et al.8 encontraron deterioro de la clase funcional en un 6 % de los pacientes, pero evidente a los 15 años de la implantación inicial de marcapasos, lo cual sugiere que la población pediátrica tolera la estimulación crónica desde VD a pesar de los efectos adversos mencionados. Nuestro grupo27 considera que la anchura del QRSe no es un índice confiable de disincronía mecánica en el paciente pediátrico, pues este solo refleja el tiempo total de activación eléctrica pero no la secuencia de activación, por lo que más que la duración del QRSe, el porcentaje o el tiempo de estimulación, debe tenerse en cuenta la secuencia de activación ventricular.
Son varias las investigaciones7,25-27 que demuestran la ausencia de correlación entre el deterioro de la función de bomba y el tiempo de estimulación, modo estimulado, cardiopatía congénita asociada, diagnóstico etiológico del BAVC y la anchura del QRSe. Gebauer et al.7 diseñaron un estudio retrospectivo con el objetivo de identificar los factores de riesgo relacionados al remodelado y la disfunción ventricular izquierda, en pacientes con marcapasos por BAVC y con 100 % de estimulación ventricular. Ellos7 encontraron la mayor incidencia de afectación al VI que se ha publicado (13,6 %), que fue más común en los individuos con BAVC de causa quirúrgica, lo cual –aunque sin correlación estadísticamente significativa– pudiera sugerir que el BAVC, en el ámbito de un cardiopatía congénita, tiene mayor riesgo de desarrollar disfunción del VI. Finalmente, identificaron la estimulación desde la pared libre del VD como único predictor de riesgo significativo de remodelado y compromiso de la función ventricular izquierda [OR=14,3; intervalo de confianza 95 % (2,3-78,2), p<0.001], mientras que no encontraron diferencias en la anchura del QRSe de los pacientes con preservación de la función de VI y aquellos con insuficiencia cardíaca7.
Recientemente, en un estudio multicéntrico, Janousek et al.26 evaluaron a 171 pacientes con estimulación desde diferentes sitios del VI y VD, y detectaron un empeoramiento significativo de las fracciones de acortamiento y de eyección del VI en los sujetos estimulados desde el VD, de ahí que sea la estimulación desde la pared libre y lateral del VD un predictor independiente de deterioro importante (FEVI≤45 %); disminución esta que se correlacionó con el grado de disincronía. Asimismo, nuestro grupo27 logró evaluar la función sisto-diastólica y la sincronía en 80 pacientes con estimulación desde el ápex de VI (AVI) y AVD, con ≥ 95 % de estimulación. Existieron diferencias significativas entre ambos grupos en cuanto a los parámetros de función sistólica y sincronía intra e interventricular, los cuales estaban comprometidos en los pacientes con estimulación desde el AVD, con una incidencia de disfunción clínica de 6,3 %. En ese estudio27 fueron identificados como predictores de riesgo, la estimulación desde el AVD y el retraso electromecánico entre el septum y la pared posterior.
Aunque las investigaciones experimentales28,29 y las realizadas en la población adulta30,31 muestran afectación de la función diastólica del VI, no existen suficientes estudios que evalúen dicha función en la población pediátrica. Tatengco et al.5 estimaron la función diastólica en 24 niños con estimulación crónica desde VD y encontraron afectación del índice máximo de llenado ventricular, pero no de otros parámetros como el llenado ventricular rápido, la diástasis y la contracción auricular. En nuestra serie27 no se detectó compromiso a largo plazo de esta función, por lo que la ausencia de otros estudios pediátricos nos hace recomendar su valoración en futuras investigaciones, con un tiempo mayor de evaluación.
Sitios alternativos de estimulación
Hasta la fecha, los sitios alternativos de estimulación ventricular desde el VD descritos son: septum medio, tractos de entrada y salida del VD (TSVD), región septal del TSVD, haz de His y las zonas parahisianas. El TSVD ha sido uno de los más estudiados, pues se utilizó inicialmente como sitio alternativo en los casos con umbrales de estimulación y detección inadecuados32. Constituye una estructura compleja, limitada superiormente por la válvula pulmonar y en su extremo inferior por la valva septal de la válvula tricúspide, y se conforma por la pared libre, la región septal y una parte de la pared anterior del VD (Figura 3A)32. La terminología de región septal del TSVD constituye un término erróneo, puesto que la zona superior está adosada a la aorta ascendente proximal y, por ende, está más en relación con esta que con el VI. Por otra parte, la pared posterior del conus arteriosus (infundíbulo) es muy alta y fina como para lograr una estimulación factible, a lo que se suma la obtención de umbrales elevados al estimular desde esta zona. Por estos motivos solo la zona septal inferior es considerada como septum verdadero. Anatómicamente esta área se sitúa debajo de la cresta supraventricular y contiene las trabeculaciones septoparietales, regiones ideales para lograr estabilidad de los electrodos de fijación activa (Figura 3B)32.
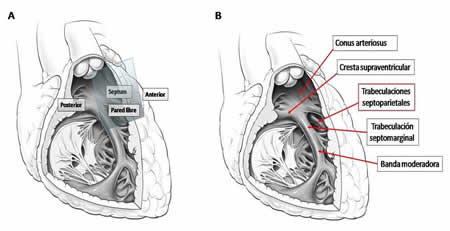
Figura 3. Anatomía cardíaca donde se destaca el TSVD. A. Visión electrofisiológica que refleja las relaciones entre la zona septal y las paredes libre y anterior del VD. B. Visión anatómica que muestra las estructuras que delimitan la región septal. Adaptada de Hillock y Mond. Europace. 2012; 14:28-3532, con permiso de los autores.
El término de TSVD no siempre es bien definido en las publicaciones y se utiliza para describir zonas del VD, como el infundíbulo, la pared libre, el septum y las áreas apexianas adyacentes. Sin embargo, es importante la diferenciación entre los sitios dentro del TSVD, pues el patrón de activación y propagación de la despolarización difieren en dependencia de la ubicación anatómica del electrodo; de hecho, no especificar el sitio preciso donde se estimula podría explicar los resultados controversiales informados33-36.
Desde el primer trabajo de Durrer et al.37, se plantea que las regiones septales del VI son las primeras zonas ventriculares en ser despolarizadas, lo cual teóricamente sugiere que si se estimula desde las áreas derechas del septum, cercanas a estas zonas, se podría obtener un patrón contráctil lo más fisiológico posible. Una investigación in vitro33 refleja cómo durante la estimulación septal (región medial), el septum se despolariza relativamente precoz, pero la onda de activación generada se propaga lentamente a través del endocardio del VI, para alcanzar su pared lateral de manera tardía. Como resultado, la distribución de acortamiento sistólico es más heterogénea en cuanto a tiempo, espacio y amplitud; se incrementan los índices de disincronía y descoordinación mecánica, y desde el punto de vista hemodinámico disminuye la pendiente dP/dt y puede reducirse la contractilidad del VI hasta en un 30 %, respecto a los valores basales33.
La evidencia clínica aún sigue siendo controversial en cuanto a los beneficios de la estimulación septal sobre la apical convencional. Tse et al.34 observaron que comparado con el AVD, la estimulación del septum produce menos defectos de perfusión y contractilidad de la pared miocárdica, y por ende, se atenúa el detrimento de la función ventricular izquierda. Aún más, en un estudio posterior, este mismo grupo de autores38 sugieren que la estimulación septal podría revertir el efecto deletéreo de la estimulación crónica desde el AVD.
En un metanálisis realizado por Shimony et al.35 se incluyeron 14 estudios randomizados y se comparó la estimulación desde el AVD (369 pacientes), con la no apical (385 casos). Fue demostrado un efecto favorable sobre la función ventricular en pacientes con estimulación septal, con períodos de evaluación mayor a 12 meses y con FEVI ≤ 45 %; no obstante, no existieron diferencias significativas en cuanto a pruebas funcionales, calidad de vida, o morbilidad y la mortalidad35. Por su parte, Kypta et al.36 no encontraron superioridad de la estimulación del septum sobre la apical convencional en términos de FEVI, capacidad funcional y niveles de péptido natriurético. Igualmente, en una investigación multicéntrica26 realizada en la población pediátrica, los autores informan iguales resultados en cuanto a la disincronía inter e intraventricular y la depresión de la función sistólica obtenida en pacientes estimulados desde el AVD y el septum.
Aunque no ha sido demostrada la inferioridad de la estimulación septal con respecto a la apical, esta no se ha generalizado en el paciente pediátrico por: ausencia de estudios aleatorizados en esta población que muestren beneficios clínicos, discrepancias en cuanto a los resultados de las investigaciones en la población adulta y las dificultades técnicas para lograr el implante definitivo del electrodo en la zona septal deseada, debido a la anatomía compleja del TSVD.
Otros sitios alternativos son el His y las zonas parahisianas. En pacientes sin alteraciones distales de conducción, la estimulación desde estas regiones induce una secuencia fisiológicamente normal de activación y por tanto, se previenen los daños asociados al patrón disincrónico39. Los primeros estudios clínicos fueron publicados por Deshmukh et al.39,40, quienes demostraron los beneficios de la estimulación hisiana permanente en 36 pacientes con miocardiopatía dilatada, FEVI de 23±11 %, fibrilación auricular persistente y QRS < 120 ms; tras 42 meses de seguimiento lograron la sobrevida de 29 pacientes, así como la mejoría de la FEVI y de parámetros clínicos y hemodinámicos de función ventricular izquierda. Por su parte, Catanzariti et al.41 evaluaron los efectos agudos en 17 pacientes con estimulación hisiana y 6 con estimulación parahisiana; al compararlos con los casos estimulados desde el AVD, los dos primeros grupos mantuvieron índices de sincronía adecuados y ausencia de insuficiencia mitral. Años más tarde, este mismo grupo42 informó los resultados de un seguimiento a largo plazo de pacientes con estimulación apexiana e hisiana, y tras 34±11 meses de seguimiento, el grupo estimulado desde el His, comparado con la estimulación desde el AVD, mostró preservación de la FEVI (57,3±8,5 vs. 50,1±8,8 %; p<0.001), incidencia menor de insuficiencia mitral (16,3±12,4 vs. 22,5±10,9 %; p=0.018), así como ausencia de índice de asincronía42.
A pesar del desarrollo y perfeccionamiento de técnicas y catéteres específicos para lograr la adecuada implementación de la estimulación del His, no existen estudios destinados a la población pediátrica. La existencia de una zona hisiana pequeña, con la complejidad que supone ubicar un electrodo permanente en el tronco hisiano y por otra parte, el hecho de que esta estructura está involucrada en la patogenia del BAVC, tanto congénito como adquirido (posquirúrgico), y que el bloqueo pueda ser electrofisiológicamente infrahisiano, imposibilitan la aplicación de esta estimulación alternativa en pediatría.
Estimulación ventricular izquierda
Basado en las evidencias que arrojan las disímiles investigaciones experimentales33,43 y clínicas26,27,44-47, el ventrículo izquierdo ha sido postulado como el sitio óptimo de estimulación en la población pediátrica. Al estimularse el AVI (Figura 1D) ocurre una despolarización precoz de esta región, lo que genera la propagación de una rápida onda de activación a todo lo largo del endocardio y en sentido ápex-base; como resultado, la pared lateral y el septum se activan de manera sincrónica mientras que la base del VD tiende a ser despolarizada tardíamente43. Por otro lado, la estimulación desde la zona septal del VI (Figura 1E) produce una rápida y sincrónica activación de todo el endocardio ventricular izquierdo, lo que produce el patrón que se asemeja más al generado durante la conducción fisiológica, aunque las regiones de la pared libre de VD son las últimas en ser despolarizadas43.
Desde ambos sitios se han obtenido parámetros de sincronía similares a los fisiológicos, como el índice de disincronía mecánica global (100-150 ms), el de descoordinación y la distribución del trabajo mecánico, por lo que se preserva la asincronía interventricular nativa33. Otros indicadores, como: contractilidad, relajación, consumo miocárdico de oxígeno, perfusión y eficiencia miocárdica, no sufren detrimentos e incluso se han determinado aumentos de la perfusión septal con la estimulación apical12,33. Tomaske et al.44 evaluaron los efectos de la estimulación crónica desde los ápex de VD y VI en 25 niños sin cardiopatía estructural. Aunque la estimulación desde el AVI se asoció a mayor duración del QRSe, en contraposición a la estimulación apical derecha, la valoración ecocardiográfica no mostró diferencias en cuanto a la función y sincronía del VI cuando se comparó con un grupo de sujetos sanos44. De forma similar, en otro estudio de cohorte45 fueron incluidos 32 pacientes pediátricos con BAVC sin cardiopatía estructural y al comparar los grupos estimulados desde la pared lateral del VI y el AVD, se estimó que los primeros preservaron la fracción de acortamiento (32,2±5,2 vs. 21,7±6,0 %; p<0.001) y el retraso electromecánico septum-pared posterior (-16±14 vs. 338±20 ms; p<0.001)45. En otras series26,27 que involucran un mayor número de casos, los resultados demuestran la superioridad de la estimulación ventricular izquierda sobre la convencional en temas de preservación de la sincronía y función cardíacas, indistintamente a que se estimule desde el septum, la pared lateral o el AVI.
Los beneficios de la estimulación ventricular izquierda han sido comparados con los derivados de la estimulación biventricular, y han demostrado su efectividad sobre todo al estimularse desde la pared lateral del VI. Vanagt et al.46 describen el caso de un paciente de 2 años con BAVC e IC por estimulación crónica desde el AVD, que se logró resincronizar con la implantación de un electrodo en la región del AVI. Asimismo, Tomaske et al.47, informan la mejoría de la función ventricular, la disincronía y el remodelado adverso en niños con estimulación crónica del VD, en quienes aparecen los efectos beneficiosos al mes de ser estimulados desde el VI.
Recomendaciones para la estimulación en pediatría
Las evidencias mostradas obligan a replantearnos cuál es el objetivo a alcanzar en un paciente pediátrico que requiera la implantación de un marcapasos permanente. Los niños muchas veces son tratados desde edades tempranas, por lo que requerirán estimulación por varias décadas; por tanto, más que estimular, debemos pensar en preservar la función ventricular, al ser capaces de seleccionar el sitio óptimo en cada uno de nuestros pacientes.
En la selección adecuada del sitio y el modo de estimulación se deben tener en cuenta aspectos, como la edad, la curva de crecimiento, el tipo de cardiopatía, la corrección quirúrgica realizada o a realizar, el estado de la conducción aurículo-ventricular, así como la presencia de cortocircuitos y anomalías venosas. Parece razonable pensar además, que la secuencia de activación de diferir si el paciente padece o no alguna cardiopatía, y más aún si se tiene en cuenta la repercusión que implica a largo plazo o las secuelas secundarias a una cirugía correctora (ej.: bloqueos de rama). Por este motivo, se recomienda seleccionar el modo y sitio de estimulación en dependencia de la presencia o no de una enfermedad estructural (Figura 4).
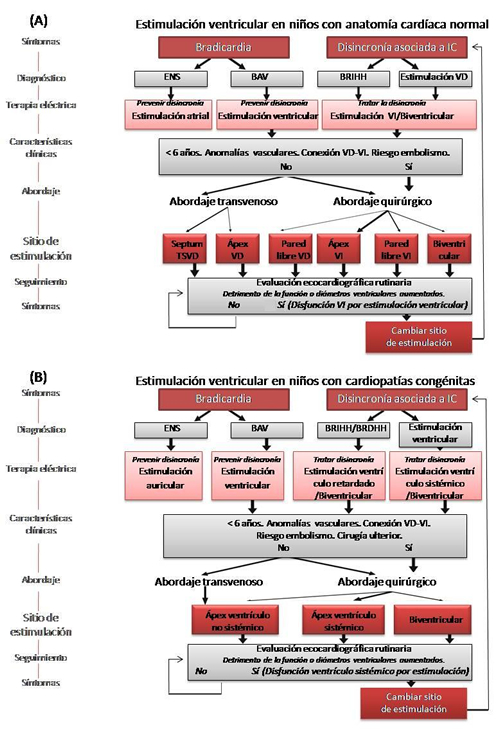
Figura 4. Recomendaciones para la selección de la estimulación óptima en pediatría. A. Pacientes con anatomía cardíaca normal. B. Pacientes con cardiopatías congénitas. Adaptada de van Geldorp et al. Heart Fail Rev. 2011; 16:305-141, con permiso del autor. BAV, bloqueo aurículo-ventricular; BRDHH, bloqueo de rama derecha; BRIHH, bloqueo de rama izquierda; ENS, enfermedad del nodo sinusal; IC, insuficiencia cardíaca; TSVD, tracto de salida del VD; VD, ventrículo derecho; VI, ventrículo izquierdo.
En neonatos, lactantes y niños pequeños se aboga por la estimulación ventricular izquierda desde el epicardio. Es práctica habitual, en nuestro centro, la implantación de un electrodo en la zona epicárdica del VI mediante toracotomía lateral izquierda, con lo que se obtienen adecuados umbrales de estimulación y detección, así como resultados estéticos óptimos; otras vías de acceso utilizadas suelen ser la esternotomía o las incisiones subxifoideas.
En el caso del niño mayor y el adolescente, generalmente es aceptada la estimulación transvenosa, y evitar siempre estimular la pared libre del VD. Dada la tolerancia de la población pediátrica a la estimulación crónica desde el AVD, aún se recomienda la implantación de electrodos endocárdicos en esta zona. Aunque sin demostrar superioridad, otra variante útil sería la colocación del electrodo a nivel del septum, y más aún si el paciente presenta un bloqueo de rama derecha tras la corrección de una cardiopatía. Igualmente, desde el acceso endocárdico se pudiera realizar estimulación ventricular izquierda por vía del seno coronario. En cualquiera de las variantes es recomendable realizar evaluaciones ecocardiográficas rutinarias. En la actualidad existen algoritmos (MVP y AAISafeR)48 integrados a los generadores que promueven tiempos mayores de activación ventricular intrínseca, sin que se detecten efectos adversos relacionados a estas terapias de estimulación.
Conclusiones
El sitio de estimulación ventricular es el mayor determinante de la preservación o el deterioro de la sincronía y la función ventricular izquierda en la población pediátrica. Aunque el VI es considerado el sitio óptimo, la tolerancia a los efectos deletéreos promovidos por la estimulación desde el AVD y la no implementación generalizada de técnicas quirúrgicas para estimular el VI, mantienen en la actualidad la preferencia del VD como sitio definitivo a estimular.
Referencias bibliográficas
van Geldorp IE, Vanagt WY, Prinzen FW, Delhass T. Chronic ventricular pacing in children: toward prevention of pacing-induced heart disease. Heart Fail Rev. 2011;16:305-14.
Vatasescu R, Shalganov T, Paprika D, Kornyei L, Prodan Z, Bodor G, et al. Evolution of left ventricular function in paediatric patients with permanent right ventricular pacing for isolated congenital heart block: a medium term follow-up. Europace. 2007;9(4):228-32.
Shalganov TN, Paprika D, Vatasescu R, Kardos A, Mihalcz A, Kornyei L, et al. Mid-term echocardiographic follow up of left ventricular function with permanent right ventricular pacing in pediatric patients with and without structural heart disease. Cardiovasc Ultrasound. 2007;5:13-7.
Moak JP, Barron KS, Hougen TJ, Wiles HB, Balaji S, Sreeram N, et al. Congenital heart block: development of late-onset cardiomyopathy, a previously underappreciated sequela. J Am Coll Cardiol. 2001;37:238-42.
Tantengco MV, Thomas RL, Karpawich PP. Left ventricular dysfunction after long-term right ventricular apical pacing in the young. J Am Coll Cardiol. 2001;37:2093-100.
Karpawich PP, Mital S. Comparative left ventricular function following atrial, septal, and apical single chamber heart pacing in the young. Pacing Clin Electrophysiol. 1997;20:1983-8.
Gebauer RA, Tomek V, Salameh A, Marek J, Chaloupecký V, Gebauer R, et al. Predictors of left ventricular remodelling and failure in right ventricular pacing in the young. Eur Heart J. 2009;30:1097-104.
Kim JJ, Friedman RA, Eidem BW, Cannon BC, Arora G, Smith O, et al. Ventricular function and long-term pacing in children with congenital complete atrioventricular block. J Cardiovasc Electrophysiol. 2007;18:373-7.
Vanagt WY, Prinzen FW, Delhaas T. Physiology of cardiac pacing in children: the importance of the ventricular pacing site. Pacing Clin Electrophysiol. 2008;31:S24-7.
Chiesa P, Cuesta A, Dutra S, Matto S, Morales J, Giudice J, et al. Miocardiopatía dilatada en la edad pediátrica por marcapasos con estimulación en el ápex del ventrículo derecho. Arch Pediatr Urug. 2008;79:125-38.
Sweeney MO, Prinzen FW. A new paradigm for physiologic ventricular pacing. J Am Coll Cardiol. 2006;47:282-8.
Sweeney MO, Prinzen FW. Ventricular pump function and pacing: physiological and clinical integration. Cir Arrhythm Electrophysiol. 2008;1:127-39.
Baller D, Wolpers HG, Zipfel J, Bretschneider HJ, Hellige G. Comparison of the effects of right atrial, right ventricular apex and atrioventricular sequential pacing on myocardial oxygen consumption and cardiac efficiency: a laboratory investigation. Pacing Clin Electrophysiol. 1988;11:394-403.
Karpawich PP, Rabah R, Haas JE. Altered cardiac histology following apical right ventricular pacing in patients with congenital atrioventricular block. Pacing Clin Electrophysiol. 1999;22:1372-7.
Spragg DD, Leclercq C, Loghmani M, Faris OP, Tunin RS, DiSilvestre D, et al. Regional alterations in protein expression in the dyssynchronous failing heart. Circulation. 2003;108:929-32.
Van Oosterhout MF, Prinzen FW, Arts T, Schreuder JJ, Vanagt WY, Cleutjens JP, et al. Asynchronous electrical activation induces asymmetrical hypertrophy of the left ventricular wall. Circulation. 1998;98:588-95.
Rosenbaum MB, Blanco HH, Elizari MV, Lázzari JO, Davidenko JM. Electrotonic modulation of the T wave and cardiac memory. Am J Cardiol. 1982;50:213-9.
Sweeney MO, Hellkamp AS, Ellenbogen KA, Greenspon AJ, Freedman RA, Lee KL, et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation. 2003;107:2932-7.
Thambo JB, Bordachar P, Garrigue S, Lafitte S, Sanders P, Reuter S, et al. Detrimental ventricular remodeling in patients with congenital complete heart block and chronic right ventricular apical pacing. Circulation. 2004;110:3766-72.
Zhang X-H, Chen H, Kai-Hang Y, Chan W-S, Lee KL, Chan H-W, et al. New-onset heart failure after permanent right ventricular apical pacing in patients with acquired high-grade atrioventricular block and normal left ventricular function. J Cardiovasc Electrophysiol. 2008;19:136-41.
Behar N, Martins RP, Daubert JC. Does paced QRS duration predict the risk of heart failure events during permanent right ventricular pacing?. Eur J Heart Fail. 2013;15:241-3.
Hayes JJ, Sharma AD, Love JC, Herre JM, Leonen AO, Kudenchuk PJ; DAVID Investigators. Abnormal conduction increases risk of adverse outcomes from right ventricular pacing. J Am Coll Cardiol. 2006;48:1628-33.
Shukla HH, Hellkamp AS, James EA, Flaker GC, Lee KL, Sweeney MO, et al; Mode Selection Trial (MOST) Investigators. Heart failure hospitalization is more common in pacemaker patients with sinus node dysfunction and a prolonged paced QRS duration. Heart Rhythm. 2005;2:245-51.
Khurshid S, Epstein AE, Verdino RJ, Lin D, Goldberg LR, Marchlinski FE, et al. Incidence and predictors of right ventricular pacing-induced cardiomyopathy. Heart Rhythm. 2014;11:1619-25.
Gebauer RA, Tomek V, Kubus P, Rázek V, Matejka T, Salameh A, et al. Differential effects of the site of permanent epicardial pacing on left ventricular synchrony and function in the young: implications for lead placement. Europace. 2009;11:1654-9.
Janousek J, van Geldorp IE, Krupicková S, Rosenthal E, Nuget K, Tomaske M, et al. Permanent cardiac pacing in children: choosing the optimal pacing site: a multicenter study. Circulation. 2013;127:613-23.
Cabrera Ortega M, Gonzales Morejón AE, Serrano Ricardo G. Left ventricular synchrony and function in pediatric patients with definitive pacemakers. Arq Bras Cardiol. 2013;101:410-7.
Litwin SE, Gorman G, Huang SK. Effect of different pacing modes on left ventricular relaxation in closed chested dogs. Pacing Clin Electrophysiol. 1989;12:1070-6.
Aoyagi T, Lizuka M, Takahashi T, Ohya T, Serizawa T, Momomura S, et al. Wall motion asynchrony prolongs time constant of left ventricular relaxation. Am J Physiol. 1989;257:883-90.
Dwivedi SK, Bansal S, Puri A, Makharia MK, Narain VS, Saran RK, et al. Diastolic and systolic right ventricular dysfunction precedes left ventricular dysfunction in patients paced from right ventricular apex. Indian Pacing Electrophysiol J. 2006;6:142-52.
Kolettis TM, Kyriakides ZS, Tsiapras D, Popov T, Paraskevaides IA, Kremastinos DT. Improved left ventricular relaxation during short-term right ventricular outflow tract compared to apical pacing. Chest. 2000; 117:60-4.
Hillock RJ, Mond HG. Pacing the right ventricular outflow tract septum: time to embrace the future. Europace. 2012;14:28-35.
Mills RW, Cornelussen RN, Mulligan LJ, Strik M, Rademakers LM, Skadsberg ND, et al. Left ventricular septal and left ventricular apical pacing chronically maintain cardiac contractile coordination, pump function and efficiency. Cir Arrhythmia Electrophysiol. 2009;2:571-9.
Tse HF, Yu C, Wong KK, Tsang V, Leung YL, Ho WY, et al. Functional abnormalities in patients with permanent right ventricular pacing: the effect of sites of electrical stimulation. J Am Coll Cardiol. 2002;40:1451-8.
Shimony A, Eisenberg MJ, Filion KB, Amit G. Beneficial effects of right ventricular non-apical vs. apical pacing: a systematic review and meta-analysis of randomized-controlled trials. Europace. 2012;14:81-91.
Kypta A, Steinwender C, Kammler J, Leisch F, Hofmann R. Long-term outcomes in patients with atrio-ventricular block undergoing septal ventricular lead implantation compared with standard apical pacing. Europace. 2008;10:574-9.
Durrer D, Van Dam RT, Freud GE, Janse MJ, Meijler FL, Arzbaecher RC. Total excitation of the isolated human heart. Circulation 1970;4:899-912.
Tse HF, Wong KK, Siu CW, Zhang XH, Ho WY, Lau CP. Upgrading pacemaker patients with right ventricular apical pacing to right ventricular septal pacing improves left ventricular performance and functional capacity. J Cardiovasc Electrophysiol. 2009;20:901-5.
Deshmukh P, Casavant DA, Romanyshyn M, Anderson K. Permanent, direct His-bundle pacing: A novel approach to cardiac pacing in patients with normal His-Purkinje activation. Circulation. 2000;101:869-77.
Deshmukh PM, Romanyshyn M. Direct His-bundle pacing: Present and future. Pacing Clin Electrophysiol 2004;27:862-70.
Catanzariti D, Maines M, Cemin C, Broso G, Marotta T, Vergara G. Permanent direct His bundle pacing does not induce ventricular dyssynchrony unlike right ventricular apical pacing. An intrapatient acute comparison study. J Interv Card Electrophysiol. 2006;16:81-92.
Catanzariti D, Maines M, Manica A, Angheben C, Varbaro A, Vergara G. Permanent His-bundle pacing maintains long-term ventricular synchrony and left ventricular performance, unlike conventional right ventricular apical pacing. Europace. 2013;15:546-53.
Peschar M, de Swart H, Michels KJ, Reneman RS, Prinzen FW. Left ventricular septal and apex pacing for optimal pump function in canine hearts. J Am Coll Cardiol. 2003;41:1218-26.
Tomaske M, Breithardt OA, Bauersfeld U. Preserved cardiac synchrony and function with single-site left ventricular epicardial pacing during mid-term follow-up in paediatric patients. Europace. 2009;11:1168-76.
van Geldorp IE, Vanagt WY, Bauersfeld U, Tomaske M, Prinzen FW, Delhaas T. Chronic left ventricular pacing preserves left ventricular function in children. Pediatr Cardiol. 2009;30:125-32.
Vanagt WY, Prinzen FW, Delhaas T. Reversal of pacing induced heart failure by left ventricular apical pacing. N Engl J Med. 2007;357:2637-8.
Tomaske M, Breithardt OA, Balmer C, Bauersfeld U. Successful cardiac resynchronization with single-site left ventricular pacing in children. Int J Cardiol. 2009;136:136-43.
Kaltman J, Ro PS, Zimmerman F, Moak JP, Epstein M, Zeltser IJ, et al. Managed ventricular pacing in pediatric patients and patients with congenital heart disease. Am J Cardiol. 2008;102:875-8.
Recibido: 23 de septiembre de 2014
Aceptado: 04 de noviembre de 2014
Subir






















