CorSalud 2014 Jul-Sep;6(3):229-234
ARTÍCULO BREVE
DETECCIÓN PRECOZ DE CARDIOTOXICIDAD INDUCIDA POR ANTRACICLINAS
Dr. Geoffrey Chibuzor Nwuruku, Dr. Juan A. Prohías Martínez, Dra. Ángela M. Castro Arca, Dr. Oyantay Mérida Álvarez, Dr. Joel Brooks Tamayo y Dr. Ricardo A. García Hernández
______________
Servicio de Cardiología. Hospital "Hermanos Ameijeiras". La Habana, Cuba.
Correspondencia: RA García Hernández. Hospital Hermanos Ameijeiras. San Lázaro 701, e/ Belascoaín y Marqués González. Centro Habana 10300. La Habana, Cuba. Correo electrónico: ramador@infomed.sld.cu
Resumen
Introducción: El cáncer es la enfermedad más temible conocida por la humanidad. La cardiotoxicidad, es una complicación del tratamiento antineoplásico, la cual puede ser detectada precozmente mediante ecocardiograma. Objetivo: Identificar las variables ecocardiográficas relacionadas con la aparición de cardiotoxicidad por antraciclinas. Método: Se realizó un estudio descriptivo, prospectivo, de corte longitudinal con todos los pacientes que ingresaron en el servicio de Hematología del Hospital Clínico-Quirúrgico "Hermanos Ameijeiras", durante el período comprendido entre enero de 2010 hasta enero de 2012. Fueron estudiados 28 pacientes, los cuales recibieron quimioterapia con antraciclinas. La información general de cada paciente, así como la inherente al ecocardiograma transtorácico, fue obtenida durante el ingreso hospitalario, al mes, a los 6 y a los 12 meses. Resultados: El 69,3 % de los pacientes que desarrollaron cardiotoxicidad eran mayores de 45 años y existió un predominio del sexo masculino (76,9 %). El 56,8 % presentó cardiotoxicidad a dosis menor de 550 mg/m2 (p=0.032). Los valores del strain rate / ε* en los pacientes que presentaron cardiotoxicidad, se redujeron significativamente al mes [0.8638/0.2 (p= 0.043) y 13.77/4.1 (p=0.031)]; mientras que la FEVI, permaneció normal [54,6±4 (p=0.036)]. En relación al volumen/presión de la aurícula izquierda, existió un incremento en los valores de referencia (21,13 ± 5,08ml y 10,91 ± 0,57mmHg), aunque sin significación estadística (p=0.217 y p=0.728). Conclusiones: Para el diagnóstico precoz de cardiotoxicidad la técnica de strain rate / ε* ha sido útil.
Palabras clave: Cardiotoxicidad, Antraciclinas, Ecocardiograma, Strain rate
Early detection of anthracycline-induced cardiotoxicity
Abstract
Introduction: Cancer is the most dreaded disease known to mankind. Cardiotoxicity is a complication of antineoplastic treatment, which can be detected early by echocardiogram. Objective: To identify echocardiographic variables related to the occurrence of cardiotoxicity by anthracycline. Method: A descriptive, prospective and longitudinal study was conducted with all patients admitted to the Hematology Department of Hermanos Ameijeiras Surgical Clinical Hospital, from January 2010 to January 2012. 28 patients who received chemotherapy with anthracyclines were studied. The general information of each patient, as well as the information concerning the transthoracic echocardiogram, was obtained during hospitalization, at one, 6 and 12 months. Results: 69.3% of patients who developed cardiotoxicity were older than 45 years and there was a predominance of males (76.9%). 56.8% had cardiotoxicity at a dose lower than 550 mg/m2 (p = 0.032). Strain rate/ε values in patients who developed cardiotoxicity were significantly reduced at one month [0.8638/0.2 (p = 0.043) and 13.77/4.1 (p = 0.031)]; while LVEF remained normal [54.6 ± 4 (p = 0.036)]. Regarding volume/pressure of the left atrium, there was an increase in the reference values (21.13 ± 5.08 ml and 10.91 ± 0.57 mmHg), although without statistical significance (p = 0.217 and p = 0.728). Conclusions: Strain rate/ε technique has been helpful for early diagnosis of cardiotoxicity.
Key words: Cardiotoxicity, Anthracyclines, Echocardiography, Strain rate
Introducción
El cáncer es la enfermedad más temible conocida por la humanidad. Algunas complicaciones surgen más por la terapia que por la enfermedad per se. Sin embargo, no debe haber dudas en cuanto a la relación riesgo/beneficio en el tratamiento antineoplásico1. Entre las terapias antineoplásicas, las antraciclinas son las mejores estudiadas y constituyen las más empleadas en el tratamiento de muchas neoplasias de tipo hematológico2. El factor más importante que limita el uso de estas drogas es la cardiotoxicidad, que está definida como la reducción de la fracción de eyección de ventrículo izquierdo (FEVI) mayor de 10 % de su valor límite normal de 55 %. Esta definición, se utiliza como criterio estricto de suspensión del tratamiento3.
La cardiotoxicidad puede ser aguda (durante la administración del fármaco o inmediatamente después), precoz (desde días hasta 12 meses posterior a su administración) o tardía (más de 12 meses)4. La forma aguda ocurre en menos del 1 % de los pacientes y es, generalmente identificada por la presencia de hipotensión, taquicardia, arritmias, pericarditis y disminución de la contractilidad miocárdica. No se requiere seguimiento cardíaca durante esta etapa, pues es transitoria y usualmente reversible5. Otros autores han coincidido en que la toxicidad precoz, es claramente dosis dependiente6,7; sin embargo, existen otros factores de riesgo como la administración intravenosa, dosis única elevada, radioterapia previa sobre el mediastino, uso concomitante de otro fármaco cardiotóxico, sexo femenino, edades extremas de la vida y el daño miocárdico subclínico preexistente8-10.
A partir de la gran utilidad que nos aporta la ecocardiografía, se diseña el presente estudio con el objetivo de evaluar, mediante ecocardiografía, las alteraciones cardiovasculares que aparecen con el empleo de antraciclinas; así como determinar la relación entre la dosis acumulativa de quimioterapia y la aparición de cardiotoxicidad por estos fármacos.
Método
Se realizó un estudio descriptivo, prospectivo, de corte longitudinal, con los 28 pacientes que ingresaron en el servicio de Hematología del Hospital Clínico-Quirúrgico "Hermanos Ameijeiras", durante el período comprendido entre enero de 2010 hasta enero de 2012. A todos se les solicitó el consentimiento informado escrito. Los criterios de inclusión fueron: edad mayor de 18 años, diagnóstico de linfoma (Hodgkin y no Hodgkin) o leucemia mieloide aguda, y tratamiento con fármacos antineoplásicos de tipo adriamicina o rubidomicina, exclusivamente.
La información general de cada paciente, así como la inherente al ecocardiograma transtorácico, fue obtenida durante el ingreso hospitalario, al mes, a los 6 y a los 12 meses.
A todos los pacientes, se les realizó ecocardiograma transtorácico con equipo Philips iE33, se les examinó el corazón a partir de las proyecciones convencionales (eje paraesternal corto y largo, y vistas apicales en 2, 4 y 5 cámaras). La FEVI, fue medida a partir de las vistas apicales con el empleo del método de área-longitud. El volumen auricular izquierdo se obtuvo mediante el método área-longitud modificado al final de la sístole ventricular, justo antes de la apertura de la válvula mitral desde dos vistas ortogonales apicales (2 y 4 cámaras, respectivamente). Para el registro del flujograma mitral y la obtención de la velocidad pico de la onda E, se utilizó el Doppler pulsado en vista apical (4 cámaras). El registro espectral mitral se obtuvo a una velocidad de barrido de 100mm/s. Desde la misma proyección, se activó el Doppler tisular (DTI) y a nivel del anillo mitral medial se obtuvo la E´. Posteriormente, se procedió a estimar la presión de la aurícula izquierda (PAI) mediante la fórmula PAI= [1,24(E/E´) + 1,91]. Para el strain (ε) y strain rate (SR)*, se mantuvo activado el DTI color con el volumen muestra colocado en el septum medio-apical, luego de adquirir al menos 3 ciclos (con óptima señal electrocardiográfica), se colocó una línea M virtual en el espesor de la pared, y se reajustó su anchura para evitar el registro del volumen sanguíneo y de ese modo, optimizar la relación señal-ruido.
Para cumplir los objetivos propuestos, se resumió la información, y se introdujo en una base de datos creada en el programa SPSS versión 16.0, para ello se utilizó el por ciento como medida de resumen para datos cualitativos, y el promedio y desviación estándar para variables cuantitativas. Se empleó la prueba exacta de Fisher para evaluar la asociación entre variables cualitativas en relación a la presencia de cardiotoxicidad; al considerar el tamaño de la muestra, se empleó la prueba de Mann Whitney para la comparación de los promedios. Se tuvo en cuenta el nivel de significación estadística, y se estableció como significativo el 95 % de probabilidad asociada, es decir, p <0.05.
Los resultados, que se compararon con autores nacionales y extranjeros, se muestran en tablas y gráficos.
Resultados
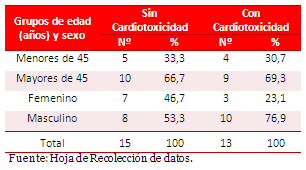
La tabla 1 muestra que el 69,3 % de los pacientes que desarrollaron cardiotoxicidad (9/13), eran mayores de 45 años, y 10 (76,9 %), eran del sexo masculino.
Tabla 1. Relación entre la edad el sexo y la cardiotoxicidad por antraciclinas.
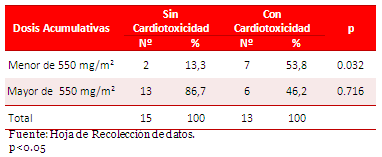
El 53,8 % de estos presentó cardiotoxicidad a dosis menor de 550 mg/m2 (Tabla 2).
Tabla 2. Relación entre la dosis de antraciclinas y la cardiotoxicidad.
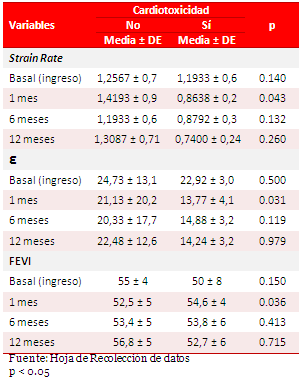
En la tabla 3 se observa la relación del SR, ε y la FEVI, en relación a la cardiotoxicidad. Nótese que tras la administración de un ciclo de antraciclinas, los valores medios del SR y ε se redujeron significativamente al mes [0,8638 ± 0,2 (p=0.043) y 13,77 ± 4,1 (p=0.031), respectivamente], mientras que la FEVI permaneció dentro de los límites normales [54,6 ± 4 (p=0.036)].
Tabla 3. Relación entre variables ecocardiográficas y cardiotoxicidad.
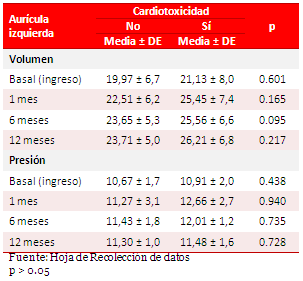
En los pacientes que desarrollaron cardiotoxicidad (Tabla 4), existió un discreto aumento en los valores de volumen (21,13 ± 8,0 ml) y presión (10,91 ± 2,0 mmHg) de la AI. Aunque no se evidenciaron diferencias significativas entre ambos grupos.
Tabla 4. Relación entre volumen/presión de la aurícula izquierda.
Discusión
En esta investigación se encontró que los pacientes más susceptibles para desarrollar cardiotoxicidad fueron los mayores de 45 años y del sexo masculino. Tal resultado contrasta con el encontrado por Grenier et al.11, donde los pacientes menores de 18 años fueron más propensos a desarrollar este tipo de complicación. Sin embargo, otro autor12 plantea que en edades extremas (menores de 18 y mayores de 65 años), aparece mayor vulnerabilidad para desarrollar cardiotoxicidad, pues consideran que los miocitos de los pacientes jóvenes son más susceptibles los fármacos antineoplásicos, así como en el caso de los pacientes adultos, el daño miocárdico subclínico preexistente.
El riesgo de cardiotoxicidad clínica se incrementa con dosis acumulativas de antraciclinas. Existen estudios13 que han registrado su aparición con dosis acumulativa menor de 400 mg/m2, y otro informe14, señala, que la incidencia de cardiotoxicidad se aproxima al 30 % con dosis acumulativa de 500 mg/m2. Nuestros resultados concuerdan con la literatura revisada, aunque llama la atención, el elevado porcentaje de casos (53,8 %) que desarrolló esta complicación, lo que probablemente pudo estar influenciado por el tamaño muestral, el mayor número de pacientes que recibieron dosis acumulativa menor a 500 mg/m2, además de la variabilidad individual.
Existen autores que plantean que la mecánica longitudinal del ventrículo izquierdo depende predominantemente del subendocardio, que es más vulnerable y sensible a la presencia de enfermedad miocárdica6,15,16. Por otro lado, la disminución de la distensibilidad conlleva a alteraciones en la relajación longitudinal, lo que produce un retardo progresivo de la torsión ventricular, que altera la función diastólica y elevalas presiones de llenado ventricular, en una fase en que la FEVI se mantiene normal6. Esta situación promueve el empleo de otras técnicas ecocardiográficas para identificar precozmente la aparición de cardiotoxicidad6,15,16. Basado en ello, otros autores, han demostrado que existe una reducción significativa del SR y ε, con dosis acumulativas muy bajas de fármacos antineoplásicos, en tanto otras variables ecocardiográficas, como la FEVI y el Doppler mitral, permanecen invariables17. Nuestros resultados coinciden con la literatura revisada, donde existió una reducción del SR/ε, siendo muy significativo, después de finalizado un ciclo de tratamiento de antraciclinas. Por lo anteriormente comentado se debe señalar, que las técnicas de SR/ε, podrían alertarnos sobre la presencia de una disfunción ventricular subyacente, asociada a la quimioterapia, a pesar de una FEVI conservada18.
El discreto aumento (no significativo) del volumen y la presión de la AI se debe a que cuando la aurícula se vacía hacia un ventrículo rígido (por el incremento de su presión telediastólica), ambos parámetros se incrementan para mantener un adecuado volumen eyectivo, debido a que durante la diástole ventricular, la AI queda expuesta directamente a las presiones del ventrículo izquierdo: indicador de la duración y gravedad de la disfunción diastólica19.
Se piensa que la suspensión de la quimioterapia, después del diagnóstico de cardiotoxicidad, aunado al tratamiento médico, pudo haber influido en la ausencia de relación entre el volumen de la AI y la presencia de cardiotoxicidad. De igual modo, los valores de presión en la AI no fueron significativos. Probablemente en esto influyeron las manipulaciones terapéuticas que se realizaron a algunos pacientes, una vez diagnosticada la cardiotoxicidad, lo cual pudo ocasionar la reducción notable de la precarga y las presiones de llenado en sentido general20.
Conclusiones
Las técnicas de SR/ε fueron útiles para el diagnóstico precoz de cardiotoxicidad.
Recomendaciones
Es necesario realizar otros estudios con mayor número de pacientes. Se considera que el criterio para la detección precoz de cardiotoxicidad, no debe circunscribirse solo a la reducción de la FEVI (mayor de 10 %), sino que debe tomarse en cuenta el empleo de otras herramientas ecocardiográficas (ε/SR), en aras de promover una valoración integral del paciente.
Nota del editor
* Strain, y strain rate son palabras del idioma inglés, cuyo significado, en el contexto de la ecocardiografía, es deformación miocárdica y deformación miocárdica en el tiempo, respectivamente (tomado de: http://www.echobasics.de/strain-cas.html). CorSalud ha decidido utilizarlas en su idioma original debido a la alta frecuencia de uso en cardiología y porque considera que no es razonable sustituirlas por otros términos que quizás no expresen con claridad las características de este tipo de variable ecocardiográfica.
Referencias bibliográficas
Cardinale D, Colombo A, Lamantia G, Colombo N, Civelli M, De Giacomi G, et al. Anthracycline-induced cardiomyopathy: clinical relevance and response to pharmacologic therapy. J Am Coll Cardiol. 2010;55(3):213-20.
Takemura G, Fujiwara H. Doxorubicin-induced cardiomyopathy: from the cardiotoxic mechanisms to management. Prog Cardiovasc Dis. 2007;49(5):330-52.
Hunt SA, Abraham WT, Chin MH, Feldman AM, Francis GS, Ganiats TG, et al. Focused update incorporated into the ACC/AHA guidelines for the Diagnosis and Management of Heart Failure in Adults: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration with the International Society for Heart and Lung Transplantation. J Am Coll Cardiol. 2009;53(15):e1-e90.
Minotti G, Salvatorrelli E, Menna P. Pharmacological foundations of cardio-oncology. J Pharmacol Exp Ther. 2010;334(1):2-8.
Yeh ET, Bickford CL ,PharmD BC. Cardiovascular complications of cancer therapy: incidence, pathogenesis, diagnosis and management. J Am Coll Cardiol. 2009;53(24):2231-47.
Eidem BS. Identification of anthracycline cardiotoxicity: left ventricular ejection fraction is not enough. J Am Soc Echocardiogr. 2008;21(12):1290-2.
Von DD, Layard MW, Basa P, Davis HL Jr, Von Hoff AL, Rozencweig M, et al. Risk factors for doxorubicin-induced congestive heart failure. Ann Intern Med. 1979;91(5):710-7.
Gharib MI, Burnett AK. Chemotherapy-induced cardiotoxicity: current practice and prospects of prophylaxis. Eur J Heart Fail. 2002;4(3):235-42.
Monsuez JJ, Charniot JC, Vighat N, Artigou JY. Cardiac side-effects of cancer chemotherapy. Int J Cardiology. 2010;144(1):3-15.
Lyu YL, Kerrigan JE, Lin CP, Azarova AM, Tsai YC, Ban Y, et al. Topoisomerase II beta mediated DNA double-strand breaks: implications in doxorubicin cardiotoxicity and prevention by dexrazoxane. Cancer Res. 2007;67(18):8839-46.
Grenier MA, Lipshultz SE. Epidemiology of antracycline cardiotoxicity in children and adults. Semin Oncol. 1998;25(4 Suppl 10):72-85.
Lipshultz SE, Alvarez JA, Scully RE. Anthracycline associated cardiotoxicity in survivors of childhood cancer. Heart. 2008;94(4):525-33.
Swain SM, Whaley FS, Ewer MS. Congestive heart failure in patients treated with doxorubicin: a retrospective analysis of three trials. Cancer. 2003;97:2869-79.
Schimmel KJ, Richel DJ, Van den Brink RB, Guchelaar HJ. Cardiotoxicity of cytotoxic drugs. Cancer Treat Rev. 2004;30(2):181-91.
Mercuro G, Caddeddu C, Piras E, Dessì M, Madeddu C, Deidda M, et al. Early epirubicin myocardial dysfunction revealed by serial Doppler echocardiography. Correlation with inflammatory and oxidative stress markers. Oncologist. 2007;1(9):1124-33.
Altena R, Perik PJ, van VeldhuisenDJ, deVries EG, Gietema JA. Cardiovascular toxicity caused by cancer treatment: strategies for early detection. Lancet Oncol. 2009;10(4):391-9.
Marwick TH, Leano RL, Brown J, Sun JP, Hoffmann R, Lysyansky P, et al. Myocardial strain measurement with 2-dimensional speckel-tracking echocardiography: Definition of normal range. JACC Cardiovasc Imaging. 2009;2(1):80-4.
Hare JL, Brown JK, Leano R, Jenkins C, Woodward N, Marwick TH. Use of myocardial deformation imaging to detect preclinical myocardial dysfunction before conventional measures in patients undergoing breast cancer treatment with trastuzumab. Am Heart J. 2009;158(2):294-301.
Pritchett AM, Jacobsen SJ, Mahoney DW, Rodeheffer RJ, Bailey KR, Redfield MM. Left atrial volume as an index of left atrial size: a population based study. J Am Coll Cardiol. 2003;41(6):1036-43.
Sawaya H, Sebag IA, Plana JC, Januzzi JL, Ky B, Cohen V, et al. Early detection and prediction of cardiotoxicity in chemotherapy-treated patients. J Am Coll Cardiol. 2011;107(9):1375-80.
Recibido: 21 de noviembre de 2013
Aceptado: 07 de enero de 2014
Subir






















