CorSalud 2014 Abr-Jun;6(2):174-180
ARTÍCULO ORIGINAL
FACTORES DE RIESGO DE FIBRILACIÓN AURICULAR POSOPERATORIA EN CIRUGÍA CARDÍACA
Dra. Elizabeth Rodríguez Rosalesa, MSc. Dr. Antonio de Arazoza Hernándezb, Dr. Francisco Vázquez Castroc y Dr. Francisco L. Moreno-Martínezd
______________
Unidad de Cuidados Coronarios. Hospital "Joaquín Albarrán". La Habana, Cuba.
Departamento de Anestesiología y Reanimación. Servicio de Cirugía Cardiovascular. Cardiocentro del Centro de Investigaciones Médico-Quirúrgicas (CIMEQ). La Habana, Cuba.
Servicio de Cardiología. Cardiocentro del CIMEQ. La Habana, Cuba.
Unidad de Hemodinámica y Cardiología Intervencionista. Cardiocentro "Ernesto Che Guevara". Villa Clara, Cuba.
Correspondencia: A de Arazoza Hernández. CIMEQ. Calle 216 y 11B. Rpto Siboney, Playa, CP 12100. La Habana, Cuba.
Correo electrónico: dearazoza@infomed.sld.cu
Resumen
Introducción: El advenimiento de nuevas técnicas de intervencionismo percutáneo, la optimización de las conductas farmacológicas y el empleo de nuevas técnicas quirúrgicas (convencionales, mínimamente invasivas y video-asistidas) han traído como resultado que casos cada vez más difíciles lleguen a los quirófanos, con un incremento en la incidencia de la fibrilación auricular posoperatoria. Objetivo: Analizar la asociación de algunas variables con la incidencia de esta arritmia en la cirugía cardiovascular. Método: Se realizó un análisis retrospectivo de los últimos 100 pacientes, de ambos sexos y mayores de 18 años, operados en el Servicio de Cirugía Cardiovascular del Cardiocentro CIMEQ, en el período de octubre de 2008 a febrero de 2010. Se analizaron 27 variables organizadas en cuatro grupos y se determinó su relación con la fibrilación auricular posoperatoria. Resultados: El 37 % de los pacientes analizados presentó este tipo de fibrilación auricular, que fue más frecuente en pacientes con enfermedad mixta (80 %) y doble valvular (66,66 %). De las variables clínicas sólo fueron significativas la fibrilación auricular previa, la valvulopatía mitral, la edad mayor de 65 años, la inestabilidad hemodinámica, el infarto miocárdico previo y la clase funcional III ó IV. Ninguna de las variables electrocardiográficas estudiadas se asoció de forma significativa a la ocurrencia de fibrilación auricular posoperatoria. Todas las variables ecocardiográficas (dilatación de ventrículo y aurícula izquierdos, dilatación de aurícula derecha y fracción de eyección menor de 55 %), y seis de las variables propias de la cirugía (empleo de circulación extracorpórea, salida de paro en fibrilación auricular o ventricular, uso de aminas en el trans o el posoperatorio, pinzamiento aórtico mayor de 120 minutos, enfermedad doble valvular y casos mixtos) se asociaron significativamente a la aparición de esta arritmia. Conclusiones: Las variables clínicas con alta asociación a la fibrilación auricular, tienen menor peso que las variables propias de la cirugía, en el caso de la fibrilación auricular posoperatoria.
Palabras clave: Fibrilación auricular, Cirugía cardíaca, Posoperatorio, Factores de riesgo
Risk factors for postoperative atrial fibrillation in cardiac surgery
Abstract
Introduction: The advent of new techniques of percutaneous intervention, the optimization of pharmacological behavior and the use of new surgical techniques (conventional, minimally invasive and video-assisted) have resulted in ever more difficult cases being treated in the operating room with an increase in the incidence of postoperative atrial fibrillation. Objective: To analyze the association among some variables and the incidence of this arrhythmia in cardiovascular surgery. Method: A retrospective analysis was conducted with the last 100 patients of both sexes, aged 18 and over, operated in the Cardiovascular Surgery Service of CIMEQ Cardiology Hospital, between October 2008 and February 2010. 27 variables arranged in four groups were analyzed and their relationship with postoperative atrial fibrillation was determined. Results: 37% of the patients analyzed presented this type of atrial fibrillation, which was more frequent in patients with mixed (80%) and double valve disease (66.66 %). Of the clinical variables only previous atrial fibrillation, mitral valve disease, age over 65, hemodynamic instability, previous myocardial infarction and III or IV functional class were significant. None of the studied electrocardiographic variables were significantly associated with the occurrence of postoperative atrial fibrillation. All echocardiographic variables (dilated left ventricle and atrium, dilated right atrium and ejection fraction below 55 %), and six of the variables that are typical of surgery (cardiopulmonary bypass, recovery from cardiac arrest in atrial or ventricular fibrillation, use of amines in trans or postoperative period, over 120 minutes of aortic clamping, double valve disease and mixed cases) were significantly associated with the occurrence of this arrhythmia. Conclusions: The clinical variables highly associated with atrial fibrillation are less significant than the variables typical of surgery, in the case of postoperative atrial fibrillation.
Key words: Atrial fibrillation, Heart surgery, Postoperative, Risk factors
Introducción
La fibrilación auricular (FA) es la arritmia más frecuente en la práctica clínica1. Fue reconocida desde la mitad del siglo XIX y a causa de su ritmo totalmente irregular se le denominó delirium cordis. No fue hasta 1899 que esta arritmia fue relacionada con una alteración electrofisiológica conocida como FA. Diez años después, en 1909, Lewis describió sus características electrocardiográficas por primera vez en humanos2-4.
Es una taquiarritmia supraventricular caracterizada por la pérdida de la activación cíclica y ordenada de las aurículas, la que se sustituye por actividad continua y desordenada. Pequeñas áreas auriculares se despolarizan simultáneamente, llevando a la pérdida de la contracción auricular organizada. Esta activación auricular no coordinada conlleva al deterioro de la función mecánica y en el electrocardiograma se observan oscilaciones rápidas u ondas fibrilatorias, que varían en amplitud, forma e intervalo, en sustitución de las ondas P; además, una respuesta ventricular irregular rápida en presencia de un tejido de conducción intacto5,6. Esta respuesta depende de las propiedades electrofisiológicas del nodo aurículo-ventricular y de otros tejidos de conducción, del tono vagal y simpático, de la presencia o ausencia de vías accesorias y de la acción de fármacos6,7. La génesis de esta arritmia tiene relación, en general, con factores crónicos de cada paciente que actúan como sustrato (cardiopatía) y con factores agudos que actúan como desencadenantes8,9.
La fibrilación auricular posoperatoria (FAPO) es la complicación más frecuente después de la cirugía cardíaca. Según las guías de actuación de la Sociedad Europea de Cardiología, en una revisión sistemática de 58 estudios realizados en más de 8.000 pacientes, esta arritmia aparece aproximadamente en el 30 % de los casos después de una cirugía de revascularización miocárdica, 40 % después de una cirugía valvular y 50 % después de una cirugía combinada de revascularización y sustitución valvular5, y conlleva a una alta morbilidad y elevados costos sanitarios1,10,11. La FAPO no sólo tiene implicaciones pronósticas, sino también una importante carga económica12,13.
En esta investigación se analiza la frecuencia de algunas variables preoperatorias y propias de la cirugía cardiovascular, relacionadas con la incidencia de FAPO durante tres años, en el Cardiocentro CIMEQ. Se analizó el comportamiento de las variables clínicas, electrocardiográficas y ecocardiográficas en el preoperatorio y el comportamiento de las variables propias de la cirugía cardiovascular y del posoperatorio que pudiesen estar en relación con la FAPO.
Método
Se realizó un análisis retrospectivo de los últimos 100 pacientes, de ambos sexos y mayores de 18 años, operados en el Servicio de Cirugía Cardiovascular del Cardiocentro CIMEQ, en el período de octubre de 2008 a febrero de 2010. Se analizaron 27 variables organizadas en cuatro grupos y se determinó su relación con la FAPO.
Se excluyeron de este estudio a los pacientes que clasifican en el grupo de FA permanente o que se encontraban en FA en el momento de la cirugía. Sí fueron incluidos el resto de las clases de FA (la diagnosticada por primera vez, la paroxística, la persistente y la persistente de larga duración) que no estuviesen fibrilando en el momento de la cirugía.
Para identificar las variables relacionadas con la FAPO se analizaron las historias clínicas de los pacientes operados por el equipo quirúrgico en el período de tiempo descrito. Estas variables se distribuyeron en cuatro grupos de la siguiente forma:
Variables clínicas: edad, sexo, existencia de FA previa, clasificación funcional según la Asociación del Corazón de Nueva York (NYHA, por sus siglas en inglés), inestabilidad hemodinámica, valvulopatía mitral, hipertensión arterial, diabetes mellitus, hipertensión pulmonar, obesidad e infarto miocárdico previo.
Variables electrocardiográficas: extrasístoles supraventriculares, bloqueo aurículo-ventricular, QRS ancho y morfología anormal de la onda P.
Variables ecocardiográficas: dilatación de aurícula izquierda, derecha, de ventrículo izquierdo, y fracción de eyección del ventrículo izquierdo (FEVI).
Variables propias de la cirugía cardiovascular: pinzamiento aórtico prolongado, empleo de circulación extracorpórea (CEC), salida del paro en FA o fibrilación ventricular, uso de aminas en el trans o en el posoperatorio inmediato, cirugía de urgencia, cirugía cardíaca previa, casos mixtos y doble valvular.
Para el análisis de los datos y las variables se utilizó el paquete estadístico SPSS para Windows XP, versión 15.0. Se empleó el método estadístico de Chi cuadrado para determinar la correlación entre las variables y su significación estadística, y la prueba de regresión lineal para analizar sus asociaciones. La relación de algunos factores predictivos independientes con la FAPO en el modelo final se expresó mediante el índice de probabilidades (odds ratio, en inglés) con un intervalo de confianza del 95 %.
Resultados
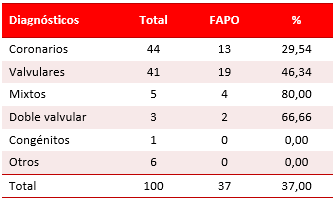
De los 100 casos estudiados, 37 presentaron FAPO (37,00 %). Su distribución, según la enfermedad de base que los llevó al quirófano, se muestra en la Tabla 1. Los pacientes con enfermedades valvulares (46,34 %) y coronarias (29,54 %) fueron los que con mayor frecuencia desarrollaron la arritmia.
Tabla 1. Distribución de la casuística según enfermedad de base y la aparición de FAPO.
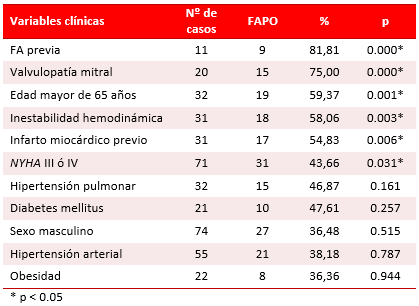
En la tabla 2 se refleja el comportamiento de las variables clínicas. La FA previa (81,81 %), la valvulopatía mitral (75 %), la edad mayor de 65 años (59,37 %), la inestabilidad hemodinámica (58,06 %), el infarto previo (54,83 %) y la clase funcional III o IV (43,66 %) fueron las que se asociaron de forma significativa con el desarrollo de FAPO. En esta serie encontramos que los pacientes que la presentaron tenían una edad de 65 ± 10,2 años, mientras que los que no, tenían una edad de 54 ± 8,7 años.
Tabla 2. Comportamiento de las variables clínicas asociadas a la FAPO.
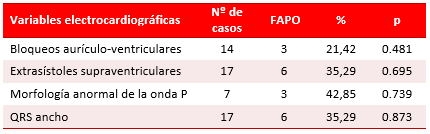
El comportamiento de las variables electrocardiográficas se muestra en la tabla 3. Estas variables fueron las que menos se relacionaron con la incidencia de FAPO y ninguna de ellas se asoció significativamente a la aparición de la arritmia.
Tabla 3. Comportamiento de las variables electrocardiográficas asociadas a la FAPO.
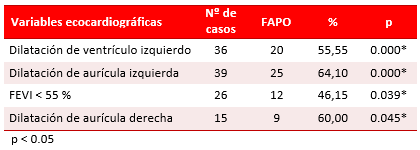
Las variables ecocardiográficas (Tabla 4) tuvieron mayor relación con la incidencia de FAPO y todas tuvieron una asociación estadísticamente significativa (p<0.01) con la aparición de FAPO. La dilatación de las aurículas izquierda (64,10 %) y derecha (60 %) fueron las que con mayor porcentaje estimularon el desarrollo de FA.
Tabla 4. Comportamiento de las variables ecocardiográficas asociadas a la FA.
Las variables propias de la cirugía cardiovascular tuvieron la más alta asociación con la aparición de FAPO (Tabla 5), y también entre sí. Solo la cirugía de urgencia (50 %, p=0.496) y la cardíaca previa (33,33 %; p=0.811) carecieron de relación con la aparición de la FAPO.
Tabla 5. Comportamiento de las variables propias de la cirugía asociadas a la FAPO.
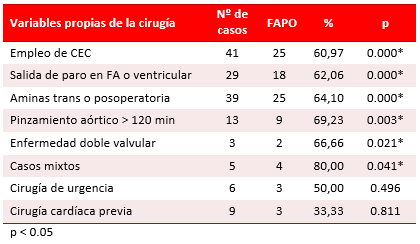
En el análisis estadístico de los tiempos de CEC y de paro anóxico (pinzamiento aórtico) como variables independientes de FAPO se encontró que los pacientes que presentaron la arritmia tenían un tiempo de CEC (123 ± 55,9 vs. 86 ± 21,7 minutos) y de paro (92 ± 30,9 vs. 55 ± 11,9 minutos) superiores a los que no la desarrollaron. Además del análisis univariado de Chi cuadrado, se realizó uno de regresión logística a todas las variables de los pacientes estudiados (Tabla 6). El uso de CEC aumenta 30,4 veces el riesgo de aparición de FAPO. La presencia de estas seis variables en un mismo paciente (uso de CEC, de aminas en el trans o posoperatorio, edad mayor de 65 años, dilatación del ventrículo izquierdo, infarto agudo de miocardio y FEVI menor del 55 %) se asocia en un 96,27 % con la aparición de FAPO.
Tabla 6. Riesgo relativo de desarrollar FAPO según algunas variables.

Discusión
En la actualidad la FA es la arritmia sostenida más frecuente en el corazón humano y también la más diagnosticada clínicamente en pacientes ambulatorios y hospitalizados1. Es la causa de aproximadamente un tercio de las hospitalizaciones debidas a alteraciones del ritmo cardíaco. El desarrollo de FA aumenta el riesgo de complicaciones cardio y cerebrovasculares, reduce la supervivencia6,14,15, duplica la mortalidad y quintuplica el riesgo de ictus, en relación con las alteraciones hemodinámicas y los fenómenos tromboembólicos que produce16-18.
Aunque aproximadamente 30 - 45 % de los casos de FA paroxística y 20 - 25 % de los de FA persistente ocurren en pacientes jóvenes sin enfermedad demostrable19, con el paso del tiempo puede aparecer una enfermedad subyacente que la cause20.
Dentro de las enfermedades cardiovasculares asociadas a la FA se pueden señalar las valvulopatías, especialmente mitral, la insuficiencia cardíaca, la cardiopatía isquémica y la hipertensión arterial, que adquiere más relevancia en presencia de hipertrofia ventricular izquierda1. Otras cardiopatías, como el prolapso de la válvula mitral, con o sin regurgitación, la calcificación del anillo mitral, el cor pulmonale y la dilatación idiopática de la aurícula derecha, también se han asociado con una alta incidencia de FA6.
Los factores desencadenantes agudos más frecuentes son: ingestión de alcohol, infarto de miocardio, pericarditis, miocarditis, embolismo pulmonar, hipertiroidismo, posterior a cirugía cardíaca y afección aguda de las vías respiratorias, aunque en aproximadamente el 80 % de los casos la presencia de FA se asocia con cardiopatía estructural1,8,9.
Aunque generalmente se trata de un suceso autolimitado, expone al paciente al riesgo de padecer insuficiencia cardíaca, hipotensión grave, shock cardiogénico y accidentes embólicos, por lo que frecuentemente requiere algún tipo de intervención terapéutica, farmacológica o eléctrica, y anticoagulación cuando perdura más de 48 horas13.
Villareal et al.21 afirman que la FA es la arritmia que aparece más frecuentemente en el posoperatorio de una revascularización miocárdica quirúrgica. Es una de las complicaciones más frecuentes después de la cirugía cardíaca y de la cirugía torácica en general y llega a afectar aproximadamente al 30 % de los pacientes, sobre todo en los primeros días del posoperatorio, con un incremento de la morbilidad y la estancia hospitalarias1. Según Archbold y Schilling22 aparece entre el 20 y el 40 % de los pacientes sometidos a este tipo de cirugía y puede alcanzar hasta un 65 %, según lo informado en un metaanálisis publicado en Annals of Internal Medicine1,23.
Aunque la FA no es una arritmia "maligna", la FAPO después de una revascularización miocárdica quirúrgica se asocia con un aumento de la mortalidad intrahospitalaria y de la aparición de accidentes cerebrovasculares; además, prolonga la estadía hospitalaria y es un predictor independiente de mortalidad a largo plazo1,24.
La dilatación de la aurícula izquierda y una menor velocidad del pico sistólico auricular del anillo mitral (onda a) se han asociado al desarrollo de FAPO25-27.
En lo referente a los factores de riesgo relacionados con su aparición, la edad avanzada ha sido uno de los más encontrados, al igual que los propios efectos de la cirugía, el empleo de CEC, los cambios en el tono simpático, el síndrome de bajo gasto cardíaco perioperatorio y las infecciones1,25,27.
Las alteraciones producidas por la intervención quirúrgica son de naturaleza hemodinámica, física y química. Entre ellas resaltan la perfusión de los órganos con un flujo laminar continuo, no pulsátil; el contacto de la sangre con superficies extrañas, como las del oxigenador y los circuitos; la hipotermia, la hemodilución y la inhibición de los sistemas de la coagulación26-28, entre otras.
La cirugía cardiovascular per se genera daño estructural cardíaco directo, como el producido por las canulaciones de las venas cava, la apertura de las aurículas, las disecciones de los anillos valvulares, entre otras; e indirecto, como el producido por el edema y las manipulaciones quirúrgicas. Este daño estructural es también responsable de las alteraciones que aparecen a la salida de la CEC y en las primeras horas del período posoperatorio. Estos mecanismos explican, por su parte, la aparición de trastornos de la contractilidad y el ritmo cardíacos29.
Numerosas series han demostrado que la FAPO prolonga la estadía hospitalaria de 1 a 5 días y que se puede transformar en una de las complicaciones más costosas, no sólo por su incidencia sino porque representa el 13 % de los reingresos en el primer mes1,12,13. La prevención o la corrección de la FAPO se reflejan directamente en la morbilidad y la mortalidad, y en las estadísticas de supervivencia de los pacientes.
Conclusiones
Las variables electrocardiográficas analizadas no se asociaron con la aparición de FAPO. En cambio las ecocardiográficas, las clínicas y las propias de la cirugía sí. Estas últimas fueron las más relacionadas con la aparición de dicha arritmia.
Referencias bibliográficas
Moreno-Martínez FL, Groning González DV, Fleites Cárdenas HA, Lagomasino Hidalgo A, González Alfonso O, Ramos Ramírez RR, et al. Reversión de fibrilación auricular paroxística con amiodarona después de una revascularización miocárdica quirúrgica sin bomba. Rev Fed Arg Cardiol. 2005;34(1):118-23.
Gambarte AJ. Génesis de la Fibrilación auricular. Potenciales mecanismos involucrados. Rev Fed Arg Cardiol. 2004; 33(3): 364-75.
Lewis T. Report CXIX. Auricular fibrillation: a common clinical condition. Br Med J. 1909;2(2552):1528.
Lewis T. The mechanism and graphic registration of the heartbeat. London: Shaw & Sons, 1925.
Bellet S. Clinical disorders of the heartbeat. 3ra. ed. Philadelphia: Lea & Febiger, 1971.
Camm J, Kirchhof P, Lip GYH, Schotten U, Savelieva I, Ernst S, et al. Guías de práctica clínica para el manejo de la fibrilación auricular. Rev Esp Cardiol. 2010;63(12):1483.e1-e83.
Prystowsky EN, Katz AM. Atrial fibrillation. En: Topol EJ, ed. Textbook of Cardiovascular Medicine. Philadelphia: Lippincott-Raven; 1998. p. 1661.
Allessie MA, Boyden PA, Camm AJ, Kléber AG, Lab MJ, Legato MJ, et al. Pathophysiology and prevention of atrial fibrillation. Circulation. 2001;103(5):769-77.
Karmelic SC. Fibrilación auricular: estado actual. Rev Méd Clín Condes. 2008;19(1):32-8.
Echahidi N, Pibarot P, O´Hara G, Mathieu P. Mechanisms, prevention, and treatment of atrial fibrillation after cardiac surgery. J Am Coll Cardiol. 2008;51(8):793-801.
Kalavrouziotis D, Buth KJ, Ali IS. The impact of new-onset atrial fibrillation on in-hospital mortality following cardiac surgery. Chest. 2007;131(3):833-9.
Hohnloser SH. Nuevas perspectivas farmacológicas en pacientes con fibrilación auricular: el ensayo ATHENA. Rev Esp Cardiol. 2009;62(5):479-81.
Wolf PA, Mitchell JB, Baker CS, Kannel WB, D´Agostino RB. Impact of atrial fibrillation on mortality, stroke, and medical costs. Arch Intern Med. 1998;158(3):229-34.
Cea-Calvo L, Redón J, Lozano JV, Fernández-Pérez C, Martí-Canales JC, Llisterri JL, et al. Prevalencia de fibrilación auricular en la población española de 60 o más años de edad. Estudio PREV-ICTUS. Rev Esp Cardiol. 2007;60(6):616-24.
Kannel WB, Wolf PA, Benjamin EJ, Levy D. Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: population-based estimates. Am J Cardiol. 1998;82(8A):2N-9N.
Moro Serrano C, Hernández-Madrid A. Fibrilación auricular: ¿estamos ante una epidemia? Rev Esp Cardiol. 2009;62(1):10-4.
Furberg CD, Psaty BM, Manolio TA, Gardin JM, Smith VE, Rautaharju PM. Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study). Am J Cardiol. 1994;74(3):236-41.
Kannel WB, Benjamin EJ. Status of the epidemiology of atrial fibrillation. Med Clin North Am. 2008;92(1):17-40.
Levy S, Maarek M, Coumel P, Guize L, Lekieffre J, Medvedowsky JL, et al. Characterization of different subsets of atrial fibrillation in general practice in France: the ALFA study. The College of French Cardiologists. Circulation. 1999;99(23):3028-35.
Brugada R, Tapscott T, Czernuszewicz GZ, Marian AJ, Iglesias A, Mont L, et al. Identification of a genetic locus for familial atrial fibrillation. N Engl J Med. 1997;336(13):905-11.
Villareal RP, Hariharan R, Liu BC, Kar B, Lee VV, Elayda M, et al. Postoperative atrial fibrillation and mortality after coronary artery bypass surgery. J Am Coll Cardiol. 2004;43:742-8.
Archbold RA, Schilling RJ. Atrial pacing for the prevention of atrial fibrillation after coronary artery bypass graft surgery: a review of the literature. Heart. 2004;90:129-33.
Maisel WH, Rawn JD, Stevenson WG. Atrial fibrillation after cardiac surgery. Ann Intern Med. 2001;135:1061-73.
Mathew JP, Fontes ML, Tudor IC y col: A multicenter risk index for atrial fibrillation after cardiac surgery. JAMA. 2004;291:1720-9.
Hogue CW, Creswell LL, Gutterman DD, Fleisher LA; American College of Chest Physicians. Epidemiology, mechanisms, and risks: American College of Chest Physicians guidelines for the prevention and management of postoperative atrial fibrillation after cardiac surgery. Chest. 2005;128(2 Suppl):9S-16S.
Creswell LL, Karis NJ. Complications of cardiopulmonary bypass and cardioplegia. En: Little AG, Merrill WH, eds. Complications in Cardiothoracic Surgery: Avoidance and Treatment. 2da ed. Oxford: Wiley-Blackwell, 2009; p. 74-142.
Mota AL, Rodrigues AJ, Evora PR. Adult cardiopulmonary bypass in the twentieth century: science, art or empiricism? Rev Bras Cir Cardiovasc. 2008;23(1):78-92.
Rinder CS. Hematologic effects and coagulopathy. En: Gravlee GP, Davis RF, Stammers AH, Ungerleider RM. Cardiopulmonary bypass: Principles and practice. 3ra. ed. Philadelphia: Lippincott Williams & Wilkins, 2008; p. 439-58.
Zakkar M, Taylor K, Hornick PI. Immune system and inflammatory responses to cardiopulmonary bypass. En: Gravlee GP, Davis RF, Stammers AH, Ungerleider RM. Cardiopulmonary bypass: Principles and practice. 3ra. ed. Philadelphia: Lippincott Williams & Wilkins, 2008; p. 321-37.
Recibido: 28 de octubre de 2013
Modificado: 09 de diciembre de 2013
Aceptado: 16 de enero de 2014
Subir






















