CorSalud 2014 Abr-Jun;6(2):195-200
CASO CLÍNICO
DISECCIÓN DE ARTERIA PULMONAR. A PROPÓSITO DE UN CASO
Dra. Ángela M. Castro Arcaa, Dr. Carlos Ramos Emperadora, Dr. Oyantay Mérida Álvareza, Dra. Zoynez Sotto Garcíaa, Dr. Ricardo A. García Hernándezb y Dr. Alan Santana Leyvab
______________
Departamento de Ecocardiografía. Servicio de Cardiología. Hospital Hermanos Ameijeiras. La Habana, Cuba.
Servicio de Cardiología. Hospital Hermanos Ameijeiras. La Habana, Cuba.
Correspondencia: AM Castro Arca. San Lázaro 701, e/ Belascoaín y Márquez González. La Habana. Cuba.
Correo electrónico: acastro@infomed.sld.cu
Resumen
La disección de la arteria pulmonar es una enfermedad extremadamente rara que se relaciona con la presencia de hipertensión pulmonar grave de larga evolución, en el curso de cardiopatías congénitas o de hipertensión pulmonar primaria. Se presenta el caso de una mujer, con antecedentes de comunicación interauricular tipo ostium secundum que se negó a recibir tratamiento quirúrgico y presentó hipertensión pulmonar suprasistémica que desarrolló un síndrome de Eisenmenger en el curso de su evolución natural, y acude a nuestro centro por dolor precordial y disnea en reposo donde se diagnostica disección de la arteria pulmonar.
Palabras clave: Disección de arteria pulmonar, Síndrome de Eisenmenger, Cardiopatías congénitas
Pulmonary artery dissection. Case report
Abstract
The dissection of the pulmonary artery is an extremely rare disease that is related to the presence of severe pulmonary hypertension of long evolution, in the course of congenital heart diseases or primary pulmonary hypertension. This is the case of a woman with a history of ostium secundum type atrial septal defect that refused to undergo surgical treatment and presented suprasystemic pulmonary hypertension secondary to Eisenmenger´s syndrome, in the course of its natural evolution, and comes to our hospital complaining of chest pain and dyspnea at rest, and where pulmonary artery dissection was diagnosed.
Key words: Pulmonary artery dissection, Eisenmeger´s syndrome, congenital cardiac diseases
Introducción
La comunicación interauricular (CIA) es la cardiopatía congénita acianótica más frecuente en la edad adulta, presente en el 40 % de los adultos con cardiopatías congénitas1.
Si esta enfermedad no es diagnosticada y corregida a edades tempranas, puede condicionar a la aparición de hipertensión pulmonar en la adultez, con la consecuente dilatación del árbol pulmonar2 y la posibilidad de desarrollar disección de la arteria pulmonar (TAP).
De acuerdo a la bibliografía consultada, la disección suele presentarse en el sitio donde la pared vascular pulmonar se torna muy lábil en relación a los cambios de presiones pulmonares existentes.
Según Senbaklavaci et al.3, el primer caso clínico fue presentado post mórtem en 1862 por Walshe. Desde entonces han existido escasos informes de pacientes diagnosticados mediante técnicas invasivas* como la angiografía pulmonar, o estudios post mórtem en el 50 % de los casos, lo cual se debe a su frecuente presentación como shock cardiogénico o muerte súbita, aunque existen comunicaciones de pacientes cuyos síntomas se limitan a dolor precordial o disnea de reposo y que se han diagnosticado durante la vida4.
En este artículo se describe, por primera vez en Cuba, el diagnóstico in vivo de una paciente con disección del TAP.
Caso clínico
Mujer de 52 años de edad y color de piel blanca, con antecedentes de CIA tipo ostium secundum no corregida e hipertensión pulmonar desde 1983, que desarrolla síndrome de Eisenmenger en el curso de su evolución natural y que acude a nuestro centro hospitalario con un episodio de dolor precordial, acompañado de disnea en reposo asociada a tos y hemoptisis, por lo cual se decide ingreso.
Al examen físico se constató facies angustiosa, cianosis peribucal (Figura 1A), dedos hipocráticos (Figura 1B), pectum carinatum y edema en miembros inferiores. A nivel del aparato respiratorio se apreció disminución global del murmullo vesicular y estertores crepitantes hasta el tercio medio de ambos hemitórax. Al examen del aparato cardiovascular se encontró pulso arterial de amplitud aumentada, ingurgitación yugular, ápex cardíaco desplazado hacia el IV espacio intercostal izquierdo y ventrículo derecho (VD) palpable. A la auscultación se encontró un primer ruido normal, el segundo, acentuado a expensas de componente pulmonar, con desdoblamiento constante; presencia de cuarto ruido derecho y soplo diastólico precoz IV/VI (Graham-Steel) audible en foco pulmonar que se irradiaba al borde esternal izquierdo. Además, en foco tricuspídeo se auscultó un soplo holosistólico que aumentaba con la inspiración, de intensidad III/VI, irradiado al apéndice xifoides, borde esternal derecho y línea axilar anterior izquierda. En el abdomen se palpó hepatomegalia a predominio del lóbulo izquierdo, que rebasaba en 4 cm el reborde costal, y la maniobra de reflujo hepato-yugular fue positiva.
Los parámetros hemo-bioquímicos se encontraban dentro de límites normales.
El electrocardiograma de superficie mostró un aumento de voltaje de la onda P, patrón de bloqueo de rama derecha e hipertrofia de VD, con signos de sobrecarga sistólica.
La radiografía de tórax (vista póstero-anterior) reveló gran cardiomegalia a predominio del VD con enorme dilatación de aurícula derecha (AD) y dilatación aneurismática del TAP (Figura 1C). Además, ausencia de trama vascular hacia la periferia de ambos pulmones (tercio externo) propia de la hipertensión de larga evolución, lo que algunos denominan "playas pulmonares".
Tabla. Valores de los parámetros ecocardiográficos medidos al ingreso.
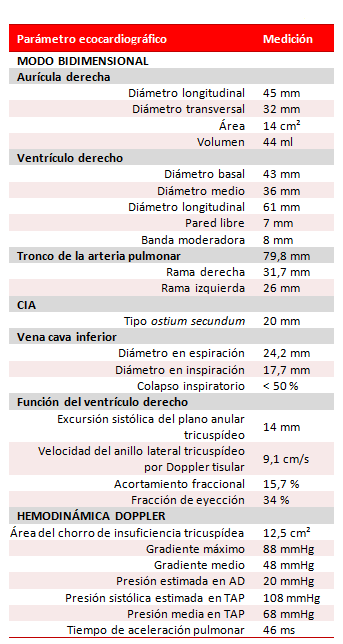
En el ecocardiograma se demostró el gran crecimiento de las cavidades derechas, donde el VD configuraba el ápex del corazón, y presencia de gran hipertrofia de sus paredes y de la banda moderadora, con función sistólica global moderadamente disminuida. En la tabla se muestran las mediciones precisas.
Existía dilatación aneurismática del TAP (Figura 2A) donde se observó un colgajo de disección que formaba la falsa luz (Figura 2B). Ambas ramas estaban dilatadas y se detectó un trombo en la derecha (Figura 2B). La curva de flujo pulmonar era de tipo IV (Figura 3A) y el tiempo de aceleración pulmonar estaba gravemente disminuido.
Por vista subcostal se demostró la existencia de CIA tipo ostium secundum con cortocircuito de derecha a izquierda demostrado por Doppler color. Se realizó además inyección de contraste salino con gran pase de burbujas hacia el corazón izquierdo con lo cual quedó demostrado el síndrome de Eisenmeger (Figura 3B).
Las cavidades izquierdas estaban rechazadas y desplazadas, el ventrículo izquierdo era pequeño con buena función sistólica global y segmentaria, y presentaba una imagen en "D" en vista de eje corto, expresión del aumento de la presión diastólica del VD.
La angiotomografía demostró dilatación de VD y AD, con gran dilatación del TAP y sus ramas; además, se observó con claridad la disección del TAP con formación de una falsa luz, y la luz verdadera (contrastada) (Figura 4).
Se impuso tratamiento médico por vía oral con furosemida (40 mg cada 12 horas), citrato de sildenafilo (50 mg cada 8 horas) y warfarina (2 mg al día). Se obtuvo mejoría clínica y se decidió su egreso con seguimiento ambulatorio por consulta externa.
En un ecocardiograma evolutivo al año y medio del diagnóstico, con motivo de un nuevo ingreso, el diámetro del TAP había aumentado hasta 90 mm.
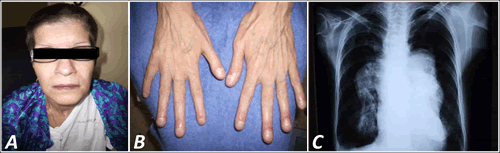
Figura 1. A. Presencia de cianosis peribucal. B. Dedos hipocráticos o en "palillo de tambor". C. Radiografía de toráx. Nótense la enorme dilatación del arco medio y de las ramas arteriales pulmonares, y la ausencia de trama vascular pulmonar periférica.
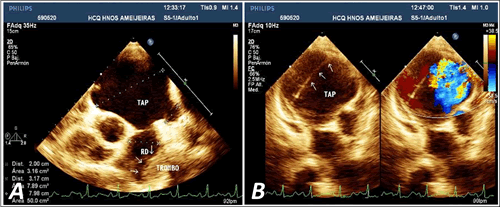
Figura 2. A. Dilatación aneurismática del TAP y sus ramas, con presencia de trombo en la rama derecha (RD). B. Colgajo intimal (flechas) con enlentecimiento de flujo y comunicación a la falsa luz.
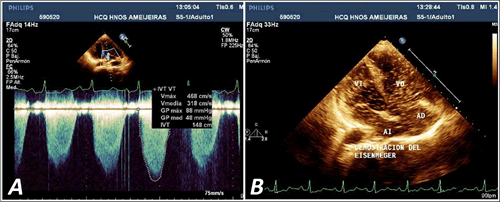
Figura 3. A. Espectro Doppler de onda contínua que muestra los gradientes de regurgitación tricuspídea. Curva pulmonar tipo IV. B. Paso de contraste salino a cavidades izquierdas después de su inyección endovenosa, lo que demuestra la inversión del cortocircuito (Síndrome de Eisenmenger). VI, ventrículo izquierdo; AI, aurícula izquierda.
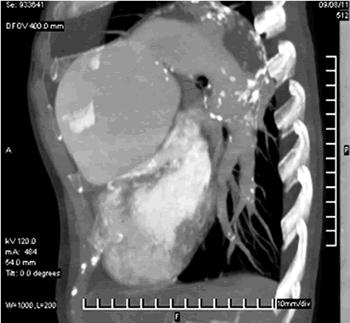
Figura 4. Angiotomografía donde se observa la gran dilatación de las cavidades derechas con enorme dilatación del TAP y sus ramas, y la disección del TAP con formación de dos luces: la verdadera (contrastada) y la falsa.
Comentario
Gran parte de los pacientes que padecen cardiopatías congénitas, particularmente aquellos con cortocircuito de izquierda a derecha relevante, desarrollarán hipertensión pulmonar si no son tratados a tiempo. La exposición persistente al incremento de presión condiciona cambios en la microvasculatura pulmonar que favorecen el aumento de la resistencia vascular pulmonar, de tal modo que si la resistencia sistémica es vencida, producirá inversión del cortocircuito5. En respuesta a la cronicidad de este trastorno, ocurre degeneración de la túnica media de la arteria pulmonar que se asocia a fragmentación de las fibras elásticas, lo cual ocasiona adelgazamiento y dilatación de la pared vascular, que condiciona el incremento de la tensión intravascular. A este fenómeno se suma el estrés parietal que favorece el desgarro de la íntima y origina la aparición de disección de esta arteria6,7 donde, a diferencia de la disección de la aorta, la falsa luz tiende a producir una ruptura distal que crea un sitio de reentrada3,8.
Por lo general, en un 80 % de los casos, la disección asienta a nivel del TAP sin involucrar las ramas, aunque raramente puede ocurrir de forma aislada en una de las ramas. Se ha descrito que la dilatación aneurismática previa favorece la aparición de la disección3,9.
Esta enfermedad es un suceso extraordinario que se presenta por igual en ambos sexos con un rango etario entre 26 y 85 años, y un pico de incidencia entre la cuarta y la séptima décadas de la vida. En pacientes jóvenes las cardiopatías congénitas constituyen la causa más frecuente, mientras que en pacientes de edad avanzada existen una amplia gama de enfermedades de causa respiratoria, inflamatoria y autoinmune que pueden producir la disección10. Dentro de las manifestaciones clínicas más frecuentes se encuentran el dolor precordial y la disnea en reposo como síntomas cardinales9.
En las dos pasadas centurias solo han sido publicados 63 casos, de los cuales 8 han sido diagnosticados con vida11, lo cual se debe al avance tecnológico en las modalidades de imagen para realizar el diagnóstico de enfermedades vasculares pulmonares, específicamente de los métodos no invasivos como el ecocardiograma, la tomografía axial computarizada y la resonancia magnética nuclear. Cabe señalar que las diferencias de aplicación de cada método dependen de su disponibilidad, la destreza del operador, la variación anatómica individual, la localización y distribución del colgajo intimal, así como de las limitaciones inherentes a cada técnica de imagen. Sin lugar a duda, el ecocardiograma resulta ser la técnica de primera línea por su fácil accesibilidad y disponibilidad, bajo costo, diagnóstico certero e inmediato a la cabecera del paciente, y sus altos valores predictivos positivos12-14.
Es oportuno comentar que la conducta terapéutica en estos pacientes no está bien definida, algunos autores son partidarios de tratamiento conservador con diuréticos de asa e inhibidores de la fosfodiesterasa V y más recientemente los inhibidores de receptor de endotelina15; otros abogan por el empleo de cirugía reconstructiva y trasplante cardiopulmonar14. Lo certero radica en la ausencia de guías de actuación médica debido al escaso informe de casos existentes en la literatura. No obstante, tenemos el criterio de que la decisión debe ser tomada individualizando al paciente para decidir tratamiento médico o quirúrgico en dependencia de su estado, comorbilidad y de la disponibilidad de tratamiento invasivo, teniendo en cuenta la relación riesgo-beneficio.
En este caso en particular, se decidió el tratamiento conservador y se instauró tratamiento médico, al tener en cuenta que una opción terapéutica indicada podría ser el trasplante cardiopulmonar, lo cual es imposible en esta paciente por su elevada comorbilidad y por todas las condiciones requeridas para realizarlo. Se implementó el tratamiento farmacológico previamente señalado con el objetivo de mejorar sus síntomas.
Resulta interesante comentar que la paciente se ha mantenido con vida desde su diagnóstico en agosto de 2011 hasta la actualidad. Recientemente ingresó descompensada, con disnea de reposo e infección respiratoria asociada, y en el ecocardiograma evolutivo se constató un incremento del diámetro del TAP; hecho extraordinariamente infrecuente que motivó la publicación de este inusual e interesante caso.
Nota del editor
* Invasiva, este término viene del inglés invasive, cuya traducción directa es "invasivo/a". Siempre que se refiera a una técnica o procedimiento diagnóstico o terapéutico, es un anglicismo. La RAE acepta este vocablo solamente como adjetivo derivado del verbo invadir. A su vez se refiere a la penetración en el organismo sólo de agentes patógenos, por lo que no parece razonable aplicarlo a procedimientos diagnósticos o técnicas de tratamiento. La traducción más correcta, aunque no perfecta, es cruento/a, que provoca efusión de sangre, también pueden ser agresivas, penetrantes. No obstante, CorSalud ha decidido aceptar invasivo/a debido a su alta frecuencia de uso y de que además, creemos no es razonable sustituir por otros términos que quizás no expresen con claridad la complejidad de este tipo de técnica.
Referencias bibliográficas
Chiesa P, Gutiérrez C, Tambasco J, Carlevaro P, Cuesta A. Comunicación interauricular en el adulto. Rev Urug Cardiol. 2009;24(3):180-93.
Co-Burn JP, William DE. Atrial Septal Defects. En: Allen HD, Driscoll DJ, Shaddy RE, FeltesTF, editors. Heart disease in infants, children and adolescents including the fetus and young adult. 7ma ed. Philadelphia: Lippincott Williams & Wilkins; 2008. p. 632-45.
Senbaklavaci O, Kaneko Y, Bartunek A, Brunner C, Kurkciyan E, Wunderbaldinger P, et al. Rupture and dissection in pulmonary artery aneurysms: Incidence, cause, and treatment – Review and case report. J Thorac Cardiovasc Surg. 2001;121(5):1006-8.
Aldrovandi A, Monti L, Corrada E, Profili M, Presbitero P. Eisenmenger syndrome complicated by pulmonary artery dissection. Eur Heart J. 2007;28(3):298.
Galie N, Manes A, Palazzini M, Negro L, Marinelli A, Gambetti S, et al. Management of pulmonary arterial hypertension associated with congenital systemic-to-pulmonary shunts and Eisenmenger´s syndrome. Drugs. 2008;68(8):1049-66.
Inayama Y, Nakatani Y, Kitamura H. Pulmonary artery dissection in patients without underlying pulmonary hypertension. Histopathology. 2001;38(5):435-42.
Walley VM, Virmani R, Silver MD. Pulmonary arterial dissections and ruptures: to be considered in patients with pulmonary arterial hypertension presenting with cardiogenic shock or sudden death. Pathology. 1990;22(1):1-4.
Yamamoto ME, Jones JW, McManus BM. Fatal dissection of the pulmonary trunk. An obscure consequence of chronic pulmonary hypertension. Am J Cardiovasc Pathol. 1988;1(3):353-9.
Wunderbaldinger P, Bernhard C, Uffmann M, Kürkciyan I, Senbaklavaci O, Herold CJ. Acute pulmonary trunk dissection in a patient with primary pulmonary hypertension. J Comput Assist Tomogr. 2000;24(1):92-5.
Song EK, Kolecki P. A case of pulmonary artery dissection diagnosed in the emergency department. J Emerg Med. 2002;23(2):155-9.
Lopez-Candales A, Kleiger RE, Aleman-Gomez J, Kouchoukos NT, Botney MD. Pulmonary artery aneurysm: review and case report. Clin Cardiol. 1995;18(12):738-40.
Steurer J, Jenni R, Medici TC, Vollrath T, Hess OM, Siegenthaler W. Dissecting aneurysm of the pulmonary artery with pulmonary hypertension. Am Rev Respir Dis. 1990;142(5):1219-21.
Mohammad K, Sahlol M, Egiebor O, Sadikot RT. Idiopathic pulmonary artery dissection: a case report. J Med Case Rep [Internet]. 2009 [Citado 2013 Oct 13];3:7426. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2737775/
Navas Lobato MA, Martín Reyes R, Lurueña Lobo P, Maté Benito I, Guzmán Hernández G, Martí de Gracia M, et al. Pulmonary artery dissection and conservative medical management. Int J Cardiol. 2007;119(1):e25-26.
Tonder N, Kober L, Hassager C. Pulmonary artery dissection in a patient with Eisenmenger syndrome treated with heart and lung transplantation. Eur J Echocardiogr. 2004;5(3):228-30.
Recibido: 14 de noviembre de 2013
Aceptado: 19 de diciembre de 2013
Subir






















