CorSalud 2014 Abr-Jun;6(2):140-147
ARTÍCULO ORIGINAL
COMPORTAMIENTO DE LA MORTALIDAD POR DISECCIÓN AÓRTICA EN CUBA
MSc. Dr. Osvaldo Valdés Dupeyróna,b, Dr. C. José Hurtado de Mendoza Amatc, Dr. C. Teresita de J. Montero Gonzálezc, Dr. Reynaldo Álvarez Santanad, MSc. Antonio de Arazoza Hernándeza y Dr. Jean L. Chao Garcíaa
______________
Servicio de Cirugía Cardiovascular. Cardiocentro del Centro de Investigaciones Médico-Quirúrgicas (CIMEQ). La Habana, Cuba.
Hospital "Dr. Luis Díaz Soto". La Habana, Cuba.
Departamento de Anatomía Patológica. Hospital "Dr. Luis Díaz Soto". La Habana, Cuba.
Departamento de Anatomía Patológica. Hospital "Hermanos Ameijeiras". La Habana, Cuba.
Correspondencia: O Valdés Dupeyrón. CIMEQ. Calle 216 y 11B. Rpto Siboney, Playa, CP 12100. La Habana, Cuba. Correo electrónico: osvaldovaldes@infomed.sld.cu
Resumen
Introducción: La disección aórtica es una enfermedad de pronóstico muy reservado, con una elevada mortalidad, aun cuando se diagnostique precozmente y se realice la intervención quirúrgica adecuada. Objetivo: Describir algunas características de los fallecidos por disección aórtica en Cuba. Método: Se realizó un estudio retrospectivo de corte transversal, que incluyó 888 fallecidos con diagnóstico de disección aórtica, incluidos en el Sistema Automatizado de Registro y Control de Anatomía Patológica (SARCAP) en Cuba, desde el año 1962 hasta el 2004. Resultados: Predominaron los grupos etarios de 65-74 y 75-84 años, con 266 (30,0 %) y 210 (23,6 %) defunciones, respectivamente. El mayor número de muertes [496 (55,9 %)] ocurrió en las primeras 24 horas. La disección aórtica tipo A de Stanford fue la de mayor frecuencia [535 diagnósticos (61,1 %)]. La causa básica de muerte más encontrada fue la propia disección aórtica (61,6 %) y la causa directa, el hemopericárdico (43,9 %). El índice de coincidencia diagnóstica fue de 33,5 % en la causa básica y de 28,8 % en la directa. Conclusiones: Los fallecidos por disección aórtica en Cuba, durante los 42 años estudiados, tuvieron predominantemente una disección tipo A de Stanford, más de 55 años de edad y una estadía hospitalaria menor de 2 meses. El mayor número de muertes ocurrió en las primeras 24 horas y el índice de coincidencia diagnóstica fue bajo.
Palabras clave: Disección aórtica, Necropsia, Coincidencia diagnóstica, SARCAP
Behavior of mortality due to aortic dissection in Cuba
Abstract
Introduction: Aortic dissection is a disease of poor prognosis, with a high mortality rate, even when it is diagnosed early and the adequate surgery is performed. Objective: To describe some characteristics of the patients who died due to aortic dissection in Cuba. Method: A retrospective cross-sectional study was conducted. It included 888 deceased patients with a diagnosis of aortic dissection, who were registered in the Automated Registration and Control System of Anatomical Pathology (SARCAP, for its acronym in Spanish) in Cuba, from 1962 to 2004. Results: The age groups from 65 to 74 and from 75 to 84 years predominated, with 266 (30.0%) and 210 (23.6%) deaths, respectively. The largest number of deaths [496 (55.9%)] occurred in the first 24 hours. Stanford type A aortic dissection was the most frequent type [535 diagnoses were made (61.1%)]. The most common underlying cause of death was aortic dissection itself (61.6 %) and the most common direct cause of death was hemopericardium (43.9%). The rate of diagnostic agreement was 33.5 % in the underlying cause and 28.8 % in direct cause. Conclusions: During the 42 years covered by the study, the patients who died from aortic dissection in Cuba predominantly had Stanford type A dissections, were over 55 years of age and had a hospital stay of less than 2 months. The largest number of deaths occurred in the first 24 hours and the rate of diagnostic agreement was low.
Key words: Aortic dissection, Necropsy, Diagnostic agreement, SARCAP
Introducción
La disección aórtica (DAo) fue descrita por el reconocido anatomista y patólogo italiano Geovani Batista Morgagni, en 1761. Fue estudiada y definida como aneurisma disecante por el médico francés René Théophile Hyacinthe Laenec en 1819, y fue diagnosticada clínicamente por primera vez por Swaine y Latham en 1885 y 1886, respectivamente1. Consiste en un desgarro de la capa íntima del vaso, que expone la capa media previamente enferma a la fuerza sistólica intraluminal de la sangre. Esta sangre penetra en la capa media y divide a la pared vascular en dos planos. El espacio lleno de sangre en las capas disecadas se convierte en falsa luz. Este proceso de disección se extiende en una longitud variable a lo largo de la aorta, generalmente en dirección anterógrada y, a veces, en sentido retrógrado desde el sitio de desgarro intimal2-4.
El término aneurisma disecante se continúa utilizando por algunos profesionales médicos en la actualidad; sin embargo, este concepto ha sido sustituido por disección aórtica desde hace varias décadas. El aneurisma y la DAo son enfermedades independientes5. La primera se puede presentar generalmente de forma aguda6, aunque posteriormente al desgarro, ocurre dilatación subsecuente progresiva de la pared externa debilitada de la aorta. Por otra parte el deterioro gradual de la pared aórtica en aneurismas crónicos puede provocar disección. Por tal motivo el término aneurisma disecante se debe reservar solamente para esta última posibilidad.
A finales del siglo pasado se introdujo el concepto de síndrome aórtico agudo, definido como un proceso agudo de la pared aórtica que condiciona un riesgo de rotura elevado con una alta morbilidad y mortalidad y que incluye: la DAo, el hematoma intramural, la úlcera penetrante, y otros cuadros como el aneurisma torácico sintomático o roto, la transección aórtica y las fistulas aorto-pulmonares, como complicación erosiva del aneurisma7.
La DAo es considerada hoy una enfermedad catastrófica, con una incidencia estimada de 5 a 30 casos por millón de habitantes. Cerca de 10.000 casos por año en los Estados Unidos sufren disección aórtica8-10. Su evolución natural sin tratamiento quirúrgico es fatal, un número considerable de enfermos muere sin recibir atención hospitalaria. El diagnóstico de DAo no se realiza en el 38 % de los pacientes y alcanza una cifra de 28 % en necropsias11. La muerte por DAo puede estar en relación con ruptura aórtica, taponamiento cardíaco, insuficiencia aórtica aguda grave, o infarto agudo de miocardio por afectación de las coronarias. La evolución del paciente con recurrencia de dolor, la presencia de shock, paro cardiorrespiratorio, y una pericardiocentesis con líquido sanguinolento hace sospechar la presencia de una DAo de la aorta ascendente que se rompe en cavidad pericárdica12,13.
En nuestro país se han realizados varios estudios sobre DAo14,15 que incluyen ensayos clínicos y necrópsicos, donde se han expuesto la incidencia y la frecuencia de dicha enfermedad, así como los aspectos fundamentales de su diagnóstico y tratamiento. Por tal motivo se decidió realizar esta investigación, con el objetivo de implicar una muestra casi total de nuestro país, en más de cuatro décadas, y así proporcionar continuidad a los trabajos que antecedieron en el conocimiento de esta enfermedad.
Método
Se realizó un estudio retrospectivo de corte transversal, que incluyó 888 protocolos de necropsias con diagnóstico de DAo, incluidos en el Sistema Automatizado de Registro y Control de Anatomía Patológica (SARCAP) en Cuba desde el año 1962 hasta el 2004.
La DAo se clasificó según la clasificación anatómica y fisiopatológica de la Universidad de Stanford, propuesta por Daily et al.16 en 1970. La cual se subdivide en:
- Tipo A: disección que afecta la aorta ascendente, que se corresponde con los tipos I y II de DeBakey17.
- Tipo B: disección que no afecta la aorta ascendente, que concierne el tipo III de DeBakey.
Para la correlación clínico-patológica se siguieron los siguientes criterios:
- Sí: Cuando la correlación fue total o parcial.
- No: Cuando no hubo correlación o los datos fueron insuficientes.
Se construyeron distribuciones de frecuencias uni y bivariadas con representación gráfica. Se aplicaron pruebas de homogeneidad chi-cuadrado y de proporciones para muestras apareadas, con características mutuamente excluyentes. Las pruebas de hipótesis, al igual que la estimación requirieron muestras aleatorias. Si no se puede justificar la aleatoriedad de la muestra entonces los resultados de las pruebas no son confiables, pero puede utilizarse su información como ayuda para decidir con lo observado en las tablas 4 y 5.
Resultados
Nuestro estudio incluyó todas las necropsias realizadas en pacientes con más de 15 años de edad, en 43 centros de todo el país, desde el año 1962 hasta el 2004, con total de 101.082 necropsias, realizadas por decenas de especialistas de Anatomía Patológica. En los primeros tres años no se informaron casos con DAo, aunque cabe señalar que el primer quinquenio, incluyó fallecidos de un solo centro. Posteriormente se fueron incorporando otros hospitales hasta formar la red actual. Los años de mayor incidencia de esta enfermedad fueron 1994 y 2000, con 133 y 103 necropsias, en ese orden.
Tabla 1. Distribución de la muestra, según la clasificación de Stanford y DeBakey.
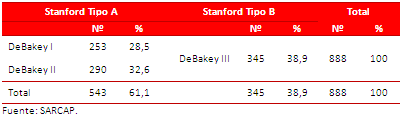
De acuerdo al tipo de DAo, según la clasificación de Stanford (Tabla 1), predominó el tipo A, en 543 fallecidos (61,1 %), de las cuales, 253 (28,5 % del total) correspondieron al tipo I de DeBakey y 290 (32,6 % del total) al tipo II. En 390 necropsias se constató derrame pericárdico por rotura de la disección a dicha cavidad. Las disecciones tipo B de Stanford y tipo III de DeBakey se encontraron en 345 fallecidos (38,9 %), incluidas 61 rotas a pleura y 81 a cavidad peritoneal.
Tabla 2. Distribución de la muestra por grupos de edad.
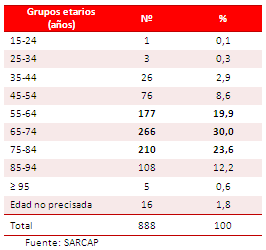
La edad promedio fue de 69 años, con un rango entre 20 y 100 años (Tabla 2). Por otra parte, existe relación entre la DAo y el incremento de la edad, observándose un mayor número de casos a partir de los 50 años. Los grupos etarios más afectados fueron los comprendidos entre 65-74 y 75-84 años, con 266 (30,0 %) y 210 (23,6 %) fallecimientos, respectivamente.
Tabla 3. Distribución de la muestra según estadía hospitalaria.
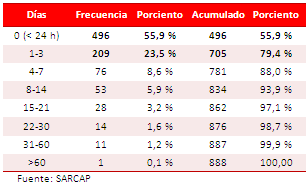
Respecto a la estadía hospitalaria (Tabla 3), se encontró el mayor número de fallecidos durante las primeras 24 horas con un total de 496 casos (55,86 %), secundado por las defunciones ocurridas entre el primer y tercer día, con 209 casos (23,86 %), lo que hace un acumulado de 79,39 %. Este parámetro fue ascendiendo con el transcurso de los días hasta completar el 99,9 % a los 60 días; es decir, que el 99,9 % de los casos falleció en el transcurso de dos meses. Sólo un enfermo tuvo una estadía hospitalaria mayor. La mortalidad se incrementó con el decursar del tiempo.
Tabla 4. Distribución de la muestra según causas básica y directa de muerte.
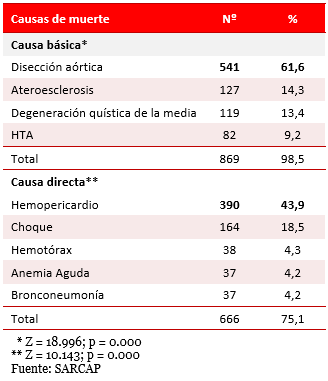
En la Tabla 4 se puede observar la distribución de la muestra según las causas básica y directa de muerte. Referente a la causa básica, la DAo fue la de mayor incidencia, encontrada en 541 certificados de defunción (61,6 %), seguida de la ateroesclerosis (14,3 %) y la degeneración quística de la media (13,4 %), y por último la HTA, con 9,2 %. Es decir el 98,5 % de las causas básicas de la muerte fueron alteraciones vasculares, las cuales están muy relacionadas en la génesis de los síndromes aórticos.
Respecto a la causa directa de muerte, el hemopericardio resultó la más frecuente, encontrada en 390 fallecidos (43,9 %); seguido por el shock, diagnosticado en 164 necropsias (18,5 %). El tercer lugar lo ocupó el derrame pleural diagnosticado en 38 defunciones (4,3 %), y por último la bronconeumonía y la anemia aguda, encontradas en 37 necropsias (4,2 % para cada causa).
Tabla 5. Distribución de la muestra según coincidencia diagnóstica.
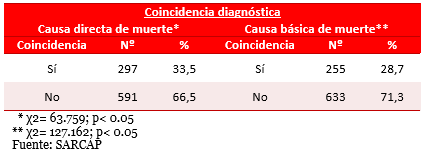
Referente a la coincidencia diagnóstica en la causa directa (Tabla 5), hubo correlación clínico-patológica total y parcial sólo en el 33,5 % de la muestra. Similar a la causa básica, con una correlación de 28,8 %. Estos resultados muestran índices de discrepancia diagnóstica elevados.
Discusión
Con el descenso en la práctica de necropsias durante las tres últimas décadas en la mayoría de los países del mundo, la obtención de una casuística extensa resulta muy complicada. A pesar de la importancia médico-legal y docente que acompaña dicho procedimiento, su empleo es cada vez más escaso18-20. En Cuba se han logrado mantener niveles aceptables en los estudios post mórtem, aunque no está exento de dicha crisis. Desde 1991 hasta 2011, los índices de necropsias en nuestro país, sin incluir fetos, fueron superiores al 33 % y en fallecidos hospitalarios se han mantenido cercanos al 60 %, en ese mismo período21.
En la actualidad existen numerosas clasificaciones de DAo, aunque la de Stanford mantiene la hegemonía, producto de su utilidad desde el punto de vista fisiopatológico22,23. La afectación de la aorta ascendente influye en el pronóstico y la conducta posterior. Es decir, cuando el desgarro incluye la aorta ascendente, el tratamiento es siempre quirúrgico. Contrariamente si la disección no afecta dicho segmento, la conducta terapéutica puede ser médica o endovascular24,25.
La DAo es una enfermedad que afecta fundamentalmente a personas de la tercera edad. Nuestros resultados son similares a los encontrados en prestigiosos estudios como el IRAD11,26,27 y el RESA28, donde predominan los pacientes de más de 60 años, probablemente por la pérdida de elasticidad y distensibilidad aórticas relacionado con el envejecimiento. Histológicamente la aorta senil muestra fragmentación de la elastina y aumento concomitante de colágeno, que favorece la disminución fisiológica de la distensibilidad e incrementa el consumo de oxígeno del miocardio entre 20 y 40 %. Datos experimentales recientes en modelos animales sugieren que el deterioro del flujo de la vasa vasorum hacia la pared de la aorta determina un aumento de su rigidez con cambios histológicos semejantes a los del envejecimiento4.
La mortalidad de la DAo sin tratamiento quirúrgico aumenta un 1 % por cada hora posterior al inicio de los síntomas29, lo que resulta que más de un tercio de los enfermos con esta enfermedad mueran en las primeras 24 horas, la mitad en 48, dos tercios en las primeras dos semanas y casi el 90 % en los primeros 3 meses. El riesgo de muerte aumenta en los pacientes con complicaciones, tales son la rotura aórtica, el accidente cerebrovascular, la isquemia visceral, el taponamiento cardíaco y la insuficiencia circulatoria. Datos de registros importantes sobre DAo aguda muestran que, en ausencia de una reparación quirúrgica inmediata, el tratamiento médico se asocia con una elevada mortalidad. Incluso con reparación quirúrgica, las tasas de mortalidad intrahospitalaria son del 10 % tras el primer día, del 12 % a los 2 días y de casi el 20 % a las 2 semanas30,31.
En alrededor del 40 % de los fallecidos en nuestra investigación no se planteó la DAo como causa básica. En este grupo se incluyen las degeneraciones quística y ateroesclerótica de la media, y la hipertensión arterial. La quística se define como un proceso degenerativo de la capa media, con pérdida o fragmentación de las fibras elásticas y células musculares lisas. La mayoría de las disecciones que aparecen en personas jóvenes obedecen generalmente a anormalidades congénitas del tejido conectivo, que afectan la capa media de la aorta32,33. Por su parte la degeneración ateroesclerótica es la alteración de la capa íntima con formación de grandes placas de ateroma que acaban produciendo una destrucción de las fibras elásticas y células musculares lisas de la capa media, lo que provoca debilidad y dilatación de la pared. La enfermedad hipertensiva incrementa la tensión absoluta sobre la pared arterial, la fuerza de contracción del ventrículo izquierdo (dp/dt) y el consumo miocárdico de oxígeno. Todo esto intensifica el daño crónico de la pared arterial y el riesgo de disección o rotura4.
En el presente estudio, el aumento de la incidencia del hemopericardio está en relación con el predominio de la DAo tipo A de Stanford. La acumulación de sangre en el saco pericárdico tiene una relación anatómica con el síndrome aórtico agudo, producto que el mayor número de DAo afectan su porción ascendente. En el 65 % de los casos el sitio de rotura intimal se localiza en dicha porción, preferentemente dentro de sus primeros 5 centímetros. Este desgarro puede progresar y romperse en la cavidad pericárdica, lo que incrementa el volumen y la presión dentro de la misma. Estas alteraciones, cuando se producen de forma aguda, hacen que el pericardio se ponga tenso y pierda su elasticidad. Cuando las presiones intrapericárdicas superan las intracavitarias, el colapso circulatorio y la muerte son inevitables si no se realiza una evacuación urgente del líquido34,35. Alrededor de un 10 % de los pacientes con diagnóstico de DAo tipo A de Stanford, sufren taponamiento cardíaco con elevado riesgo de muerte36,37.
Por su parte, el shock está vinculado con las pérdidas sanguíneas, el dolor y el fallo cardíaco es secundario a la insuficiencia aórtica aguda o a infarto agudo de miocardio. El derrame pleural guarda relación con las disecciones de la aorta torácica y es más frecuente que ocurra en la pleura izquierda. La bronconeumonía se encontró en enfermos que sobrevivieron los primeros días, y es debida a complicaciones intrahospitalaria sépticas, pues no guardan relación directa con la causa que generó su ingreso, en la mayoría de los casos, en unidades de cuidados intensivos.
La DAo presenta un cuadro clínico muy bien definido, pero su comienzo agudo, puede desorientar al médico. En la mayoría de las ocasiones se diagnostica infarto de miocardio14, tromboembolismo pulmonar, pericardititis12 y otras afecciones. Las discrepancias clínico-patológicas oscilan entre 25 y 52 %, pero cuando se analizan particularmente los síndromes aórticos estos porcentajes están cercanos e incluso superiores al 50 %38-41. Gee42 encontró 58,8 % de discrepancia en el aneurisma aórtico, Cameron y McGoogan43, 57,9 % y Fares et al.44, 64,2 %; resultados que coinciden con los del presente estudio. Además, en un estudio realizado en la provincia de Cienfuegos en 55 fallecidos por DAo, el diagnóstico al ingreso sólo se corroboró en el 18,18 % de los casos15; contrariamente, Battle et al.45 sólo encontraron un índice de discrepancia de 28,1 %.
Conclusiones
Los fallecidos por DAo en Cuba, durante los 42 años estudiados, tuvieron predominantemente una DAo tipo A de Stanford, más de 55 años de edad y una estadía hospitalaria menor de 2 meses. El mayor número de muertes ocurrió en las primeras 24 horas y el índice de coincidencia diagnóstica fue bajo.
Referencias bibliográficas
Carbonell Cantí C. Historia de la cirugía de la aorta torácica. En: Vaquero C, ed. Cirugía de la aorta torácica. Valladolid: Gráficas Andrés Martín SL, 2010; p. 15-32.
Tsai TT, Isselbacher EM, Trimarchi S, Bossone E, Pape L, Januzzi JL, et al. Acute type B aortic dissection: does aortic arch involvement affect management and outcomes? Insights from the International Registry of Acute Aortic Dissection (IRAD). Circulation. 2007;116(11 Suppl):I150-6.
Ince H, Nienaber CA. Tratamiento de los síndromes aórticos agudos. Rev Esp Cardiol. 2007;60(5):526-41.
Isselbacher EM. Enfermedades de la aorta. En: Braunwald. Tratado de Cardiología. T II. 6ta ed. México: McGraw-Hill Interamericana, 2005; p. 1739-40.
Coselli JS, Conklin LD, LeMaire SA. Thoracoabdominal aortic aneurysm repair: rewiew and update of current strategies. Ann Thorac Surg. 2002;74(5):S1881-4; discussion S1892-8.
Golledge J, Eagle KA. Acute aortic dissection. Lancet. 2008;372(9632):55-66.
Vilacosta I, San Román JA, Aragoncillo P, Ferreirós J, Mendez R, Graupner C, et al. Penetrating atherosclerotic aortic ulcer: documentation by transesophageal echocardiography. J Am Coll Cardiol. 1998;32(1):83-9.
Santo AH, Puech-Leão P, Krutman M. Trends in aortic aneurysm- and dissection-related mortality in the state of São Paulo, Brazil, 1985-2009: multiple-cause-of-death analysis. BMC Public Health [Internet]. 2012 [citado 2013 Nov 14];12:859. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3527140/pdf/1471-2458-12-859.pdf
Braverman AC. Aortic dissection: prompt diagnosis and emergency treatment are critical. Cleve Clin J Med. 2011;78(10):685-96.
Braverman AC. Acute aortic dissection: clinician update. Circulation. 2010;122(2):184-8.
Hagan PG, Nienaber CA, Isselbacher EM, Bruckman D, Karavite DJ, Russman PL, et al. The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease. JAMA. 2000;283(7):897-903.
Cury Rezende P, Borges Viana V, Benvenuti LA. Caso 2/2011 - Paciente joven, del sexo masculino, con cuadro de dolor torácico tipo pleurítico, hipotensión, sudoresis profusa, con ECG sin alteraciones isquémicas agudas y marcadores de lesión miocárdica negativos. Arq Bras Cardiol. 2011;96(4):e62-8.
Kelly BS. Evaluation of the elderly patient with acute chest pain. Clin Geriatr Med. 2007;23(2):327-49.
Valdés Dupeyrón O, Villar Inclán A, Nafeh Abiz-Reck M, Pedroso J, Guevara González L, Chao González N, et al. Tratamiento quirúrgico de las enfermedades de la aorta ascendente. Estudio de tres años. Rev Arg de Cir Cardiovasc. 2011;IX(1):47-59.
Olivert Cruz M, Romero Cabrera AJ, Bembibre Taboada R, Bermúdez López J. Disección aórtica. Estudio en un decenio (1987-1997). Rev Cubana Med. 2000;39(4):217-21.
Daily PO, Trueblood HW, Stinson EB, Wuerflein RD, Shumway NE. Management of acute aortic dissections. Ann Thorac Surg. 1970;10(3):237-47.
DeBakey ME, Beall AC, Cooley DA, Crawford ES, Morris GC, Garrett HE, et al. Dissecting aneurysms of the aorta. Surg Clin North Am. 1966;46(4):1045-55.
Burton EC, Phillips RS, Covinsky KE, Sands LP, Goldman L, Dawson NV, et al. The relation of autopsy rate to physicians´ beliefs and recommendations regarding autopsy. Am J Med. 2004;117(4):255-61.
Burton JL, Underwood JC. Necropsy practice after the «organ retention scandal»: requests, performance, and tissue retention. J Clin Pathol. 2003;56(7):537-41.
Sanz-Ortiz J, Mayorga M, Martín A. Autopsia clínica en Oncología: ¿está en crisis? Med Clin (Barc). 2011;137(7):317-20.
Hurtado de Mendoza Amat J, Montero González TJ, Ygualada Correa I. Situación actual y perspectiva de la autopsia en Cuba. Rev Cubana Salud Pública. 2013;39(1):135-47.
Ladouceur M, Fermanian C, Lupoglazoff JM, Edouard T, Dulac Y, Acar P, et al. Effect of beta-blockade on ascending aortic dilatation in children with the Marfan syndrome. Am J Cardiol. 2007;99(3):406-9.
Contreras Zúñiga E, Zuluaga Martínez SX, Gómez Mesa JE, Ocampo Duque V, Urrea Zapata CA. Diseccion aórtica: estado actual. Rev Costarric Cardiol. 2009;11(1):19-27.
Kahn SL, Dake MD. Stent graft management of stable, uncomplicated type B aortic dissection. Perspect Vasc Surg Endovasc Ther. 2007;19(2):162-9.
Ford PF, Farber MA. Role of endovascular therapies in the management of diverse thoracic aortic pathology. Perspect Vasc Surg Endovasc Ther. 2007;19(2):134-43.
Rampoldi V, Trimarchi S, Eagle KA, Nienaber CA, Oh JK, Bossone E, et al. Simple risk models to predict surgical mortality in acute type A aortic dissection: the International Registry of Acute Aortic Dissection score. Ann Thorac Surg. 2007;83(1):55-61.
Rogers AM, Hermann LK, Booher AM, Nienaber CA, Williams DM, Kazerooni EA, et al. Sensitivity of the aortic dissection detection risk score, a novel guideline-based tool for identification of acute aortic dissection at initial presentation. Results from the International Registry of Acute Aortic Dissection. Circulation. 2011;123(20):2213-8.
Evangelista A, Padilla F, López-Ayerbe J, Calvo F, López-Pérez JM, Sánchez V, et al. Registro Español del Síndrome Aórtico Agudo (RESA). La mejora en el diagnóstico no se refleja en la reducción de la mortalidad. Rev Esp Cardiol. 2009;62(3):255-62.
Song KJ, Kang SJ, Song JM, Kang DH, Song H, Chung CH, et al. Factors associated with in-hospital mortality in patients with acute aortic syndrome involving the ascending aorta. Int J Cardiol. 2007;115(1):14-8.
Suzuki T, Mehta RH, Ince H, Nagai R, Sakomura Y, Weber F, et al. Clinical profiles and outcomes of acute type B aortic dissection in the current era: lessons from the International Registry of Aortic Dissection (IRAD). Circulation. 2003;108(Suppl 1):II312-17.
Mehta RH, Suzuki T, Hagan PG, Bossone E, Gilon D, Llovet A, et al. Predicting death in patients with acute type A aortic dissection. Circulation. 2002;105(2):200-6.
Senay S, Alhan C, Toraman F, Karabulut H, Dagdelen S, Cagil H, et al. Endovascular stent-graft treatment of type A dissection: case report and review of literature. Eur J Vasc Endovasc Surg. 2007;34(4):457-60.
Ince H, Nienaber CA. Diagnosis and management of patients with aortic dissection. Heart 2007;93(2):266-70.
Nienaber CA, Eagle KA. Aortic dissection: new frontiers in diagnosis and management. Part II: Therapeutic management and follow-up. Circulation. 2003;108(6):772-8.
Santini F, Luciani GB, Montalbano G, Messina A, Faggian G, Mazzucco A. Acute type A aortic dissection: an update on a still challenging disease. J Cardiovasc Med (Hagerstown). 2007;8(2):102-7.
Braverman AC, Thompson R, Sanchez L. Diseases of the aorta. In: Bonow RO, Mann DL, Zipes DP, Libby P, eds. Braunwald´s Heart Disease: A Textbook of Cardiovascular Medicine. 9th ed. Philadelphia: Elsevier Science, 2011; p. 1309-37.
Hiratzka LF, Bakris GL, Beckman JA, Bersin RM, Carr VF, Casey DE, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and management of patients with Thoracic Aortic Disease: A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine. Circulation. 2010;121(13):e266-369.
Shojania KG, Burton EC, McDonald KM, Goldman L. Changes in rates of autopsy-detected diagnostic errors over time: A systematic review. JAMA. 2003;289(21):2849-56.
Royal College of Pathologists of Australasia Autopsy Working Party. The decline of the hospital autopsy: a safety and quality issue for healthcare in Australia. MJA. 2004;180(6):281-5.
Spiliopoulou C, Papadodima S, Kotakidis N, Kuotselinis A. Clinical diagnoses and autopsy findings. A retrospective analysis of 252 cases in Greece. Arch Pathol Lab Med. 2005;129(2):210-4.
Arce FP, Ondiviela R, Val Bernal JF. Discordancias clínico-patológicas en la autopsia. Experiencia del Hospital Marqués de Valdecilla. XXIX Reunión de la SEAP. Madrid, España; 6 Febrero 2007.
Gee WM. Causes of death in a hospitalized geriatric population: an autopsy study of 3000 patients. Virchows Arch A Pathol Anat Histopathol. 1993;423(5):343-9
Cameron HM, McGoogan E. A prospective study of 1152 hospital autopsies: II. Analysis of inaccuracies in clinicial diagnoses and their significance. J Pathol. 1981;133(4):285-300.
Fares AF, Fares J, Fares GF, Cordeiro JA, Nakazone MA, Cury PM. Clinical and pathological discrepancies and cardiovascular findings in 409 consecutive autopsies. Arq Bras Cardiol. 2011;97(6):449-55.
Battle RM, Pathak D, Humble CG, Key CR, Vanatta PR, Hill RB, et al. Factors influencing discrepancies between premortem and postmortem diagnoses. JAMA. 1987;258(3):339-44.
Recibido: 09 de diciembre de 2013
Aceptado: 07 de enero de 2014
Subir






















