CorSalud 2014 Abr-Jun;6(2):155-166
ARTÍCULO ORIGINAL
FACTORES DE RIESGO DE MORBILIDAD LUEGO DE LA DERIVACIÓN CAVOPULMONAR TOTAL
MSc. Dr. Alfredo M. Naranjo Ugalde, Dr.C. Eugenio Selman-Housein Sosa, Dr.C. Luis E. Marcano Sanz, MSc. Dra. Maritza Oliva Pérez, MSc. Dra. M. Teresa Consuegra Chuairey y MSc. Dra. Eutivides Aguilera Sánchez
______________
Cardiocentro Pediátrico “William Soler”. La Habana, Cuba.
Correspondencia: AM Naranjo Ugalde. Cardiocentro Pediátrico William Soler. Calle 100 y Perla, Altahabana. Boyeros, CP 10800. La Habana. Cuba. Correo electrónico: naranjob@infomed.sld.cu
Resumen
Introducción: La arritmia, la disfunción ventricular y la disminución de la capacidad funcional aparecen en la evolución posquirúrgica de los pacientes con derivación cavopulmonar total. La detección de factores de riesgo de esta morbilidad es esencial para mejorar la evolución. Objetivo: Identificar estos factores de riesgo en pacientes con derivación cavopulmonar total intraatrial y extracardíaca. Método: Se realizó un estudio de cohorte prospectivo desde enero de 1992 hasta enero de 2012 en el CardiocentroPediátrico "William Soler". Se construyeron distribuciones de frecuencias y tablas de contingencia. La asociación entre variables cualitativas se analizó mediante la prueba de independencia Ji cuadrado; para las cuantitativas, con la prueba t de Student. Para la identificación de factores de riesgo se utilizó la regresión logística binaria. Resultados: Se estudiaron 74 pacientes en un tiempo promedio de seguimiento de 8 años. Trece pacientes presentaron arritmias y se identificó como factor de riesgo a la aparición posoperatoria de insuficiencia aurículo-ventricular moderada o grave. Once pacientes desarrollaron disfunción ventricular moderada o grave. Se detectó asociación con la variación de la masa ventricular. La disminución de la capacidad funcional se detectó en 33 pacientes con asociación a la disfunción ventricular. Conclusiones: La insuficiencia aurículo-ventricular que aparece después de la derivación cavopulmonar total debe tratarse por ser un factor de riesgo de nuevas arritmias. La disminución de la masa ventricular en estudios evolutivos debe orientar el diagnóstico y tratamiento de disfunción ventricular y disminución de la capacidad funcional en pacientes operados con derivación cavopulmonar total.
Palabras clave: Derivación cavopulmonar total, Corazón univentricular, Factores de riesgo, Morbilidad
Morbidity risk factors after total cavopulmonary shunt
Abstract
Introduction: Arrhythmia, ventricular dysfunction and decreased functional capacity appear in the surgical outcome of patients with total cavopulmonary shunt. Detection of risk factors for this morbidity is essential to improve outcomes. Objective: To identify these risk factors in patients with intraatrial and extracardiac total cavopulmonary shunt. Method: A prospective cohort study was conducted from January 1992 to January 2012 at William Soler Cardiology Hospital. Frequency distributions and contingency tables were built. The association between qualitative variables was analyzed by Ji-square test of independence, for quantitative, with the Student t test. The binary logistic regression was used to identify risk factors. Results: 74 patients were studied at an average follow-up time of 8 years. Thirteen patients had arrhythmias and it was identified as a risk factor for postoperative occurrence of moderate or severe atrioventricular failure. Eleven patients developed moderate or severe ventricular dysfunction. Association with ventricular mass variation was detected. Decreased functional capacity was detected in 33 patients with associated ventricular dysfunction. Conclusions: Atrioventricular failure that appears after total cavopulmonary shunt should be treated since it is a risk factor for new arrhythmias. The decrease in ventricular mass in evolutionary studies should guide the diagnosis and treatment of ventricular dysfunction and decreased functional capacity in patients operated with total cavopulmonary shunt.
Key words: Total cavopulmonary shunt, Univentricular heart, Risk factors, Morbidity
Introducción
El objetivo del tratamiento quirúrgico de los pacientes con corazón univentricular es la creación de un sistema hemodinámico que desvíe hacia las arterias pulmonares el retorno venoso sistémico sin el impulso contráctil de una cavidad ventricular. La derivación cavopulmonar total (DCPT) u operación tipo Fontan1, es la opción quirúrgica paliativa actual. Se realiza en uno o dos tiempos quirúrgicos y las técnicas más usadas son la intraatrial2 y la extracardíaca3.
Después de la DCPT, la ventaja de prolongar la expectativa de vida de estos pacientes se acompaña de la aparición de morbilidad asociada a la nueva forma de circulación de la sangre. El ventrículo único funciona como una bomba que de manera pasiva recibe la circulación pulmonar y de manera activa impulsa la circulación sistémica. El flujo sanguíneo depende de las diferencias de presión entre el retorno venoso, los vasos pulmonares y la diástole ventricular. El incremento de la impedancia pulsátil (aórtica) y no pulsátil (pulmonar) en serie, aumenta las resistencias vasculares y la poscarga4. Cuando no funciona, aparecen señales clínicas de bajo gasto cardíaco, congestión sistémica e hipoxemia.
La descarga brusca del retorno de ambos territorios de las venas cava, produce desequilibrio entre el volumen del ventrículo y el sanguíneo, aumento de la presión venosa y enlentecimiento del flujo transpulmonar. El tratamiento en dos etapas, primero la derivación parcial de la vena cava superior y luego la inferior, permite que los cambios sean progresivos5.
Aun cuando existe una selección del paciente de acuerdo a criterios hemodinámicos preoperatorios de buen funcionamiento de la derivación, aparece una disminución de la capacidad para el ejercicio, hay disfunción ventricular,arritmias, tromboembolia, enteropatía perdedora de proteínas y disfunción hepática a mediano y largo plazo6.
Las arritmias son la expresión clínica de un sustrato electrofisiológico de circuitos potenciales múltiples por dilatación, cirugía o disposición anómala de las vías de conducción.Parece lógica la relación entre la aparición de arritmias posquirúrgicas con la edad de realización de la DCPT y, para algunos, con el tipo de técnica7, con la presencia de arritmias preoperatorias, con la pérdida del ritmo sinusal, la insuficiencia valvular, el síndrome de heterotaxia, el ventrículo derecho dominante y el tiempo de seguimiento8.
En estos pacientes hay una disminución de la capacidad funcional y una disminución del consumo de oxígeno de 50 a 60 % para la edad9. Durante el ejercicio ocurre un aumento de la presión pulmonar, disminución anormal del volumen diastólico final y la frecuencia cardíaca aumenta poco10.
Los factores de riesgo de esta evolución son difíciles de determinar, se citan la selección del paciente, las opciones técnicas, la variabilidad en el tiempo de seguimiento,la edad de la indicación quirúrgica, el síndrome de heterotaxia, la morfología ventricular derecha, la insuficiencia aurículo-ventricular (AV) moderada o grave, y la presión y la resistencia pulmonares elevadas11.
Las derivaciones cavopulmonares se introdujeron en el Cardiocentro Pediátrico "William Soler" en el año 1990 junto a la estrategia quirúrgica de dos estadios. En la literatura médica nacional hay acercamientos a la experiencia en el tratamiento quirúrgico de los corazones univentriculares12, sin embargo no existe un estudio sobre la morbilidad posoperatoria a mediano y largo plazo. Con la hipótesis de que durante la evolución posoperatoria se pueden identificar los factores de riesgo de nuevas arritmias, disfunción ventricular y disminución de la capacidad funcional, se diseñó un estudio prospectivo con el objetivo de identificarlos en pacientes con DCPT intraatrial y extracardíaca.
Método
Se realizó un estudio de cohorte prospectivo, desde enero de 1992 a enero de 2012 en el Cardiocentro Pediátrico "William Soler" (CPWS).
La muestra se constituyó de pacientes operados con DCPT intraatrial o extracardíaca que sobrevivieron al año de operados, cuyos tutores legales expresaron su consentimiento para la inclusión en esta investigación. Se excluyeron a los pacientes con derivación atriopulmonar previa con conversión a derivación cavopulmonar y a quienes sería imposible mantener el seguimiento evolutivo en el tiempo mínimo de estudio posoperatorio de un año. Salieron del estudio los pacientes cuyos tutores decidieron revocar el consentimiento otorgado y a quienes no se les realizó el seguimiento evolutivo en el tiempo mínimo de un año por causa diferente a mortalidad posoperatoria.
La muestra quedó constituida por 74 pacientes: 43 operados con DCPT intraatrial y 31 con DCPT extracardíaca.
La realización de una u otra técnica quirúrgica resultó de la decisión del equipo quirúrgico actuante en cada paciente. Se trabajó según las guías de buenas prácticas del CPWS para la anestesia, la cirugía en ambas modificaciones técnicas, el uso de la circulación extracorpórea, la protección miocárdica y los cuidados posquirúrgicos13.
El diagnóstico de arritmias se exploró mediante electrocardiograma y se definió como nueva arritmia, la aparición posoperatoria de cualquier alteración patológica diferente al ritmo sinusal.
La función ventricular se evaluó por ecocardiograma a través de la fracción de eyección. Se definió la disfunción ventricular como la fracción de eyección ventricular menor a 50 %14.
La capacidad funcional o tolerancia al ejercicio de los pacientes fue evaluada a través de una prueba ergométrica, con protocolo de Bruce sobre estera rodante15. Se definió como disminuida la capacidad funcional esperada en ergometría igual o menor a 65 %16.
Se midieron las presiones arteriales pulmonares y diastólicas ventriculares al final de la intervención quirúrgica. Se halló la media de la variación de estas presiones en el tiempo de seguimiento de los pacientes a quienes se les indicó estudio hemodinámico al menos una vez después de la DCPT. Se relacionó esta variación con la morbilidad.
Se obtuvo el índice entre la masa ventricular hallada por ecocardiograma y el área de la superficie corporal. Para el cálculo de la variación del índice de masa ventricular, se halló la diferencia entre la medición realizada en el preoperatorio de la derivación total y el último examen posoperatorio.
Se calcularon los tiempos entre la derivación parcial y la total además del tiempo vivido con la derivación total hasta el final del estudio para cada paciente.
Los datos se recogieron durante ingresos hospitalarios programados en el período preoperatorio de la DCPT y en cuatro momentos posteriores, al año de operado, a los tres y cinco años de la intervención y en un momento final. Se almacenaron y procesaron en una base creada en el programa estadístico SSPS 13.5 (SPSS Inc., Chicago, Illinois, Estados Unidos).
Se construyeron distribuciones de frecuencias y tablas de contingencia. Como medidas de resumen se emplearon los porcentajes para las variables cualitativas, y medias y desviaciones estándar en las cuantitativas. Para el análisis de asociación entre variables cualitativas se empleó la prueba no paramétrica de independencia Ji cuadrado de Pearson y la prueba exacta de Fisher. Para las variables cuantitativas se empleó la prueba paramétrica t de Student previo análisis de homogeneidad de varianzas.
Para la identificación de factores de riesgo se utilizó la regresión logística binaria. Se relacionaron las siguientes variables:
Dependientes: Arritmias, disfunción ventricular de riesgo y capacidad funcional disminuida.
Independientes: Edad, diagnóstico morfológico, heterotaxia, tipo de derivación cavopulmonar total, cirugía en uno o dos tiempos, intervalo entre la derivación parcial y la total, tipo de ventrículo principal, diagnóstico morfológico, insuficiencia valvular moderada o grave, presiones arterial pulmonar y ventricular de riesgo preoperatorias, variación posoperatoria de estas presiones, variación del índice de masa ventricular y tiempo de evolución.
Se analizó el exponencial de los coeficientes (Expβ) del modelo como estimadores del índice de probabilidades (OR - Odds Ratio, en su idioma original). Para evaluar la calidad del ajuste se utilizó el estadígrafo de Hosmer y Lemeshow.
Para validar los resultados en términos de significación se consideró todo valor de p ≤ 0,05 para el estadígrafo asociado a la prueba y se utilizó un nivel de confianza de 95 %. Para analizar la relevancia clínica se calculó el riesgo relativo (RR). Se calcularon como medidas de impacto, la reducción absoluta del riesgo (RAR) y el número necesario de pacientes a tratar para reducir un suceso (NNT) o el número necesario a dañar (NND) con sus correspondientes intervalos de confianza de 95 %.Se identificó como intervención a los factores que mostraron en el análisis univariado una relación significativa con el efecto analizado.
Se contó con la autorización de la dirección y con la aprobación del Consejo Científico y del Comité de Ética del Cardiocentro Pediátrico "William Soler". El proyecto recibió el aval de la Academia de Ciencias de Cuba del Ministerio de Ciencia, Tecnología y Medio Ambiente. Se respetó lo establecido en los principios básicos de la Declaración de Helsinki que contiene las recomendaciones a seguir en la investigación biomédica17.
Resultados
Se realizó seguimiento posoperatorio a 74 pacientes, 43 con DCPT intraatrial y 31 con técnica extracardíaca. La variación de la masa ventricular se calculó en 50 pacientes (67,5 %) de los 74 evaluados al menos una vez después del año de operado y a 31 (41,9 %) se les realizó estudio hemodinámico en alguno de los ingresos programados después de un año de operado. El resto de las variables analizadas luego del año de la intervención se recogieron en el 100 % de los sobrevivientes al posoperatorio inmediato.
La arritmia se presentó en 13 pacientes (Tabla 1). El RR fue mayor en pacientes con diagnóstico diferente a la atresia tricuspídea y con relación significativa en quienes presentaron insuficiencia AV posoperatoria moderada o grave [p<0,01; RR 7,47 (IC 95 % 3,15 a 17,7)]. El valor de la reducción absoluta del riesgo de arritmia con insuficiencia AV posoperatoria fue negativo [RAR -0,61 (IC 95% -0,9 a -0,31)], lo cual indica un aumento del riesgo. El número necesario a dañar fue bajo [NND 2 (IC 95% 2 a 4)], lo que significa una alta frecuencia de presentación de las arritmias en pacientes con insuficiencia AV posoperatoria de rango moderada o grave.
Tabla 1. Arritmias. Análisis univariado.
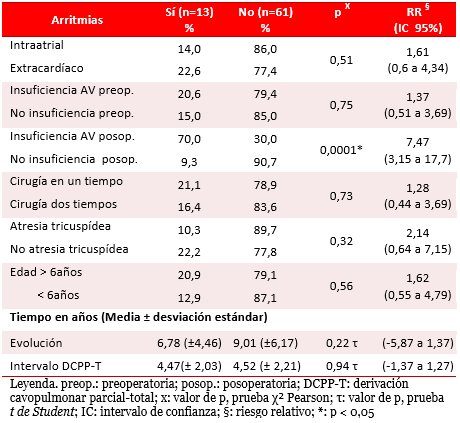
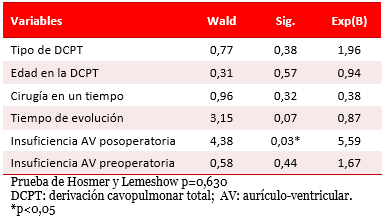
El análisis multivariado mostró una probabilidad cinco veces mayor de desarrollar arritmias (p=0,03; Exp β 5,59), cuando hay insuficiencia AV posoperatoria (Tabla 2).
Tabla 2. Arritmias. Análisis multivariado.
La disfunción ventricular se presentó en 11 pacientes, siete de ellos con la opción terapéutica intraatrial (Tabla 3). Fue más frecuente en pacientes con diagnóstico diferente a la atresia tricuspídea y con ventrículo principal izquierdo. De los pacientes con disfunción preoperatoria, el 25 % presentó disfunción posoperatoria. Aunque el intervalo entre las derivaciones parcial y total y el tiempo de seguimiento en los pacientes en quienes se detectó disfunción ventricular fueron mayores con respecto a quienes no presentaron esta complicación, las diferencias no fueron significativas.
Tabla 3. Disfunción ventricular. Análisis univariado.
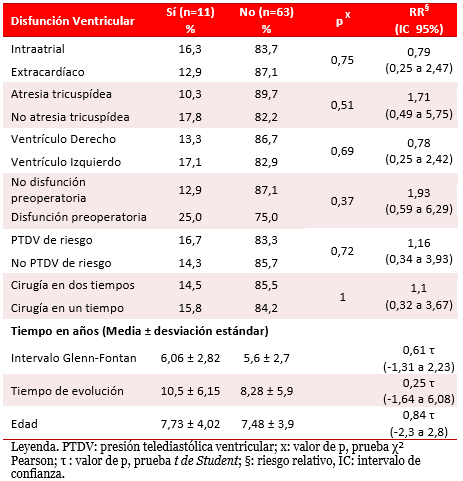
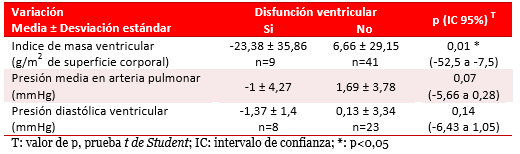
Se encontró asociación entre la disfunción ventricular y la disminución del índice de masa ventricular, sin cambios significativos que relacionaran las variaciones de presión arterial pulmonar o ventriculares con la disfunción ventricular (Tabla 4).El análisis multivariado no identificó algún factor de riesgo de disfunción ventricular posoperatoria.
Tabla 4. Disfunción ventricular y variación del índice de masa, presión pulmonar y ventricular.
La disminución moderada o grave de la capacidad funcional se detectó en 33 pacientes. La tabla 5 muestra una mayor incidencia en los pacientes con DCPT intraatrial; en los que se operaron con más de seis años de edad, y en los operados en dos etapas. Se encontró asociación entre la disminución de la capacidad funcional y la disfunción ventricular posoperatoria [p=0,04; RR 1,83 (IC 95 % 1,14 a 2,9)]. La disminución de la capacidad funcional durante la evolución posoperatoria con disfunción ventricular, mostró una reducción absoluta de riesgo con valor negativo; o sea, un aumento del riesgo [RRA de -0,33 (IC 95% -0,62 a -0,04)] y NND 4 (IC 95% 2 a 25).
Tabla 5. Disminución de la capacidad funcional. Análisis univariado.
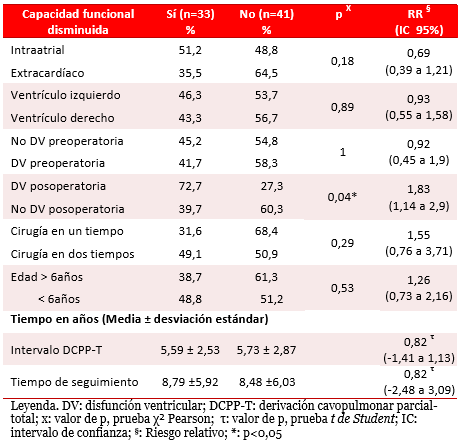
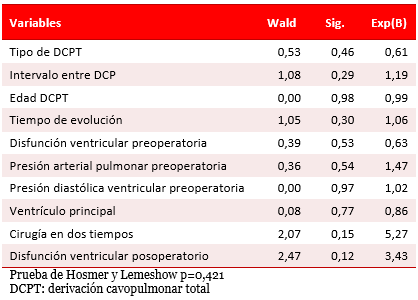
El análisis multivariado (Tabla 6) mostró una probabilidad mayor de ocurrencia de esta complicación relacionada con los estadios quirúrgicos y la disfunción ventricular posoperatoria; pero sin relación significativa.
Tabla 6. Disminución de la capacidad funcional. Análisis multivariado.
Discusión
Las arritmias se presentan relacionadas con la edad en la historia natural de pacientes en quienes no se ha realizado cirugía univentricular o con tetralogía de Fallot, transposición de grandes vasos o drenaje anómalo total de venas pulmonares sin tratamiento quirúrgico8.Las causas probables son la hipoxemia y el aumento de las presiones auriculares, lo cual no hace exclusiva esta complicación de la DCPT, sino de las particularidades hemodinámicas auriculares y sus consecuencias en el tiempo. Los pacientes con DCPT muestran disfunción del nodo con el transcurso del tiempo como consecuencia de la disminución de la respuesta de las células nodales a la modulación neural18. La causa de taquiarritmias pudiera hallarse en las áreas de conducción lenta entre la vena cava inferior, la válvula tricúspide y el seno coronario que producen retraso electrofisiológico después de incisiones, parches auriculares, aumento del estrés de la pared auricular o una lesión congénita8.
Las arritmias posoperatorias se citan con más frecuencia en la variedad intraatrial aunque la diferencia entre las tasas de incidencia para ambas variantes disminuye con el tiempo de observación19,20.La experiencia en este trabajo difiere, ya que un mayor porcentaje de pacientes con la opción extracardíaca presentaron esta complicación, pero coincide conlos resultados de Kumar et al.21, lo cual pudiera explicarse por la realización de la operación a pacientes de más edad, quienes han vivido en hipoxia mayor tiempo y con posibles cambios auriculares por dilatación. Ambas técnicas quirúrgicas incluyen incisiones en sitios con receptores o terminaciones vagales, la cara superior auricular derecha y la cresta terminal22, por lo que el estímulo para la aparición de circuitos de reentrada existe en ambas.
La variante extracardíaca no evita la aparición de arritmias y dificulta su tratamiento con técnicas de ablación por la imposibilidad de mapear el territorio auricular a través de acceso venoso profundo23.
En un estudio de 520 pacientes de siete centros24, tampoco se encontraron diferencias en la aparición de arritmias en relación con el tipo de DCPT. Otros factores de riesgo de arritmias citados son la edad de realización de la DCPT, la existencia preoperatoria de arritmias, la insuficiencia AV moderada o grave en el preoperatorio, el síndrome de heterotaxia y el tiempo vivido con una DCPT8,25. Ninguno fue identificado en el estudio del CPWS.
Ono et al.26 demostraron que los pacientes con disfunción ventricular y arritmias mejoraron luego de realizar fenestración de la derivación. La estrategia de trabajo en el CPWS es realizar fenestración en todas las variantes de DCPT, probablemente esto haya incidido en la aparición de menos episodios de arritmia posoperatoria en esta cohorte.
Robbers-Visser et al.27 relacionan la aparición de arritmias, en seis años de seguimiento, a la morfología derecha ventricular, sin encontrar tampoco relación con la técnica. Un grupo del Instituto del Corazón en Berlín28 detectó como factores de riesgo la variante intraatrial y la morfología derecha ventricular, lo cual no se demostró en el trabajo del CPWS.
Un estudio de seguimiento promedio de seis años de 65 pacientes con DCPT extracardíaca detectó la aparición de arritmias en 4,7 % en relación con la realización previa de derivación cavopulmonar parcial29. La cirugía en dos tiempos, por la manipulación del área del nodo sinusal, expone al riesgo del proceso de inflamación y cicatrización con potencial arritmogénico aumentado con respecto a quien no ha recibido cirugía previa. Quizás habría que aceptar la existencia de una alteración del sistema de conducción en este tipo de pacientes, que a pesar de las estrategias usadas, produce la pérdida del ritmo sinusal29.
Sinha et al.30 encontraron relación entre la insuficiencia AV preoperatoria y la aparición de arritmias en el posoperatorio inmediato. La cirugía valvular asociada al completamiento de la derivación cavopulmonar aumenta los tiempos quirúrgicos pero no incrementa de manera significativa la morbilidad y mortalidad perioperatorias31.
En la investigación del CPWS no se identificó algún factor preoperatorio para la aparición de arritmias, quizás por la selección apegada a criterios de buen funcionamiento o bajo riesgo de disfuncion13,32.
Como factor de riesgo de arritmias posoperatorias, se identificó a la existencia de insuficiencia AV posoperatoria, lo cual confiere importancia al esfuerzo por evitar este residuo o secuela quirúrgica y coincide con la experiencia de Brown y colaboradores33, quienes abogan por la opción intraatrial, ya que permite la reparación de la válvula por el acceso auricular a la lesión orgánica detectada en el preoperatorio.
El análisis de las opciones ante la disfunción de la DCPT, la ausencia de dispositivos de asistencia ventricular y las indicaciones para trasplante cardíaco incluye la disfunción grave ventricular atribuible a arritmias crónicas y al efecto inotrópico negativo de drogas antiarrítmicas34,35. Esta experiencia hace pensar en la opción quirúrgica que trate la causa de la arritmia antes de que ésta deteriore las condiciones generales del paciente.
La detección de insuficiencia AV de rango moderado en la evaluación posoperatoria debe justificar la reintervención quirúrgica del paciente con el objetivo de reparar la lesión valvular y evitar la aparición de arritmias limitantes de la función de la DCPT. La referencia a la reparación valvular después de la DCPT es muy escasa36,37. Menon et al.36 exponen en un estudio retrospectivo la reintervención de 61 pacientes, 72 % con arritmias,a un tiempo promedio de 4,7 años de realizada la operación tipo Fontan. Mostraron peor evolución quienes tenían además enteropatía perdedora de proteínas o disfunción ventricular grave, por lo que la indicación quirúrgica debe preceder la aparición de alguna otra complicación asociada a la circulación univentricular.
Los trabajos prospectivos aleatorizados con ambas técnicas son improbables por implicaciones éticas, por lo que quizás con estudios de Holter sistematizados se pueda detectar la incidencia más cercana a lo real del tipo de arritmia y su momento de aparición, dato no explorado en este estudio.
El intervalo mayor entre la derivación cavopulmonar parcial y su completamiento, favorece, para algunos autores, el tiempo libre de las complicaciones, por lo que recomiendan demorar el momento de la DCPT y considerar el uso de la variante extracardíaca por la posibilidad de utilizar conductos acordes al peso corporal38. El presente trabajo no demostró tampoco relación del intervalo entre ambas derivaciones cavopulmonares con la morbilidad estudiada.
La realización de la derivación cavopulmonar parcial evita la dilatación en ventrículos con sobrecarga de volumen por fístulas quirúrgicas previas, la hipertrofia en pacientes en quienes se aplicó cerclaje pulmonar o con estenosis pulmonar nativa, la fibrosis miocárdica resultante de la hipoxemia mantenida y la descarga ventricular brusca al realizar la DCPT en un tiempo quirúrgico39. Es probable que un mayor tiempo solo con la derivación parcial permita una mejor remodelación como respuesta a la descarga ventricular y una evolución más favorable en el completamiento de la derivación.
La reducción de la precarga ventricular mejora la contractilidad y disminuye el efecto de la hipoxemia mantenida sobre el miocardio con fibrosis e isquemia subendocárdica5. No obstante, la experiencia en pacientes operados entre los dos y cuatro años de edad quienes no alcanzaron la tercera década de sus vidas por deterioro de la función ventricular, imprime importancia al tiempo vivido con la DCPT40.
Nakamura et al.41 buscaron los factores de riesgo de disfunción ventricular en estudios hemodinámicos de 48 pacientes durante un promedio de 18 años e identificaron mejor función en los ventrículos izquierdos, y como factor de riesgo la edad de indicación de la derivación y el tiempo vivido con ella.
No se encontraron en este estudio del CPWS coincidencias en ese sentido. El riesgo de presentar disfunción ventricular posoperatoria pudiera ser mayor, si hubo disfunción preoperatoria, quizás porque la recuperación total del daño ventricular previo no se garantiza con la derivación, sino que retarda su manifestación clínica o agravamiento.
En un estudio de las variables hemodinámicas de pacientes con DCPT con excelente evolución en un promedio de 18 años42, se encontró una fracción de eyección media de 49,3 % (rango de 20 a 63 %) que mostraba diferencias significativas con el grupo control y se concluyó que los sobrevivientes con excelente evolución pueden mostrar disfunción ventricular pero volumen y masa ventriculares normales.
Tanto el aumento de la masa como su disminución fuera de límites de normalidad se corresponden con el aumento significativo y progresivo de presiones diastólicas que acompañan la disfunción ventricular y de la derivación41,43.
La disminución evolutiva del índice de masa ventricular, hallazgo de este trabajo del CPWS, debe llamar la atención sobre la disminución de la función ventricular posoperatoria y motivar la adopción de medidas terapéuticas que impidan o retarden la remodelación ventricular consecuente.
No se identificó algún factor de riesgo de disfunción ventricular entre los posibles analizados, por lo que quizás se deba buscar en estudios futuros, el papel de la variación de las resistencias sistémicas o de la poscarga en el origen de esta complicación.
El incremento del gasto cardíaco durante el ejercicio es mínimo en la circulación tipo Fontan por la incapacidad de aumentar la precarga y por la dependencia de la resistencia vascular pulmonar44.En estudios de tolerancia al ejercicio con un intervalo promedio de cinco años se encontraron mejores parámetros de capacidad funcional en niños que en adultos y diferencia significativa entre el primer estudio y el último con decrecimiento en ambas edades. La tolerancia al ejercicio disminuye en la medida que aumenta el tiempo vivido con la derivación total45,46.
Ohuchi et al.42 en el análisis de la evaluación cada cinco años de los pacientes con operaciones tipo Fontan, encontraron una reducción progresiva de la capacidad funcional entre 55 y 50 % en los pacientes que clasificaron como no excelentes. La única alteración hemodinámica que diferenció a los pacientes que requirieron ingresos de quienes no, fue el aumento de la presión diastólica ventricular, lo cual expresa disfunción.
En este estudio del CPWS, la presencia de disfunción ventricular posoperatoria duplicó la probabilidad de disminución moderada o grave de la capacidad funcional (RR 1,83; IC 95 % 1,14 a 2,29). El NND fue bajo y esto hace más probable la expresión clínica de dicha complicación si aparece en el estudio ecocardiográfico una disminución de la fracción de eyección.
Hubo un porcentaje mayor de pacientes con capacidad funcional disminuida que se operaron con más de seis años de edad, sin diferencias significativas en la edad de indicación de la derivación total, intervalos entre derivaciones o tiempo vivido con la DCPT. Este resultado es quizás consecuencia de la aplicación de un protocolo uniforme en la indicación quirúrgica en cuanto a condiciones hemodinámicas en cada momento del período que se estudió.
Aunque no hubo relación significativa, el porcentaje de pacientes con DCPT intraatrial que presentó disminución de la capacidad funcional fue mayor al del grupo de DCPT extracardíaca, lo que coincide con lo observado por Anderson et al.47, quienes tampoco encontraron relación con la morfología el ventrículo principal.
Resultó llamativo, que un porcentaje mayor de los pacientes con cirugía en dos tiempos mostraron disminución de la capacidad funcional, lo que pudiera explicarse por la repercusión de dos períodos posoperatorios y los períodos de rehabilitación de cada uno de ellos, el control familiar sobre la actividad física del paciente, su rehabilitación, la percepción individual de salud, así como por la diferencia en las edades en que se operaron y el tiempo de seguimiento48.
En la experiencia del CPWS no se identificaron como factores de riesgo de morbilidad la técnica de derivación ni el tiempo vivido con la DCPT.
Los estudios periódicos se realizaron con uno o dos años de diferencia. La reducción del intervalo en el seguimiento posoperatorio futuro permitirá la detección temprana de los factores de riesgo identificados y se podrán disminuir las probabilidades de presentar signos de disfunción con complicaciones graves como las descritas.
En el diseño del estudio no se incluyó la influencia de los tratamientos médicos en la incidencia de las complicaciones, sólo la aparición de ellas en el período de seguimiento, lo cual pudiera modificar los datos originales al no contabilizar algún paciente que no manifestó alguna de las complicaciones por imposición de tratamiento previo. Otra limitante es la diferencia de tiempo de seguimiento, teniendo en cuenta que mientras más tiempo se siga a un paciente con DCPT, mayor probabilidad hay de que aparezcan algunas de las complicaciones exploradas. Debido a los riesgos asociados al procedimiento, no todos los pacientes accedieron al estudio por cateterismo cardíaco en el posoperatorio.
Conclusiones
La edad en que se realiza la derivación total, el intervalo entre las derivaciones parcial y total o el tipo de DCPT no son factores de riesgo de aparición de arritmias, disfunción ventricular o disminución de la capacidad funcional. La insuficiencia valvular AV moderada o grave de aparición posoperatoria es un factor de riesgo de arritmias y su detección debe inducir cambios terapéuticos para evitar una de las complicaciones más limitantes en los pacientes con una DCPT. La detección de la disminución del índice de masa durante el seguimiento posoperatorio es un indicador de la probable aparición de disfunción ventricular en los pacientes con DCPT, lo que debe generar acciones terapéuticas por ser un factor de riesgo de disminución de la capacidad funcional. La evaluación periódica y sistemática postoperatoria permite la detección precoz de indicadores de posibles complicaciones de la circulación univentricular y su prevención.
Referencias bibliográficas
Fontan F, Baudet E. Surgical repair of tricuspid atresia. Thorax. 1971;26(3):240-8.
de Leval MR, Kilner P, Gewillig M, Bull C. Total cavopulmonary connection: a logical alternative to atriopulmonary connection for complex Fontan operations. Experimental studies and early clinical experience. J Thorac Cardiovasc Surg. 1988;96(5):682-95.
Marcelletti C, Corno A, Giannico S, Marino B. Inferior vena cava-pulmonary artery extracardiac conduit. A new form of right heart bypass. J Thorac Cardiovasc Surg. 1990;100(2):228-32.
Gewillig M, Brown SC, Eyskens B, Heyins R, Ganame J, Budts W, et al. The Fontan circulation: who controls cardiac output? Interact Cardiovasc Thorac Surg. 2010;10(3):428-33.
Gewillig M, Brown SC, Heying R, Eyskens B, Ganame J, Boshoff DE, et al. Volume load paradox while preparing for the Fontan: not too much for the ventricle, not too little for the lungs. Interact Cardiovasc Thorac Surg. 2010;10(2):262-5.
Hosein RB, Clarke AJ, McGuirk SP, Griselli M, Stumper O, De Giovanni JV, et al. Factors influencing early and late outcome following the Fontan procedure in the current era. The ´Two Commandments´? Eur J Cardiothorac Surg. 2007;31(3):344-52; discussion 353.
Collins KK, Rhee EK, Delucca JM, Alexander ME, Bevilacqua LM, Berul CI, et al. Modification to the Fontan procedure for the prophylaxis of intra-atrial reentrant tachycardia: short-term results of a prospective randomized blinded trial. J Thorac Cardiovasc Surg. 2004;127(3):721-9.
Deal BJ. Late arrhythmias following Fontan surgery. World J Pediatr Congenit Heart Surg. 2012;3(2):194-200.
Diller GP, Giardini A, Dimopoulos K, Gargiulo G, Müller J, Derrick G, et al. Predictors of morbidity and mortality in contemporary Fontan patients: results from a multicenter study including cardiopulmonary exercise testing in 321 patients. Eur Heart J. 2010;31(24):3073-83.
Gewillig M. Clinical research to optimize the Fontan concept: a long, difficult, but rewarding, journey. Eur J Cardiothorac Surg. 2013;43(1):154-5.
deLeval MR, Deanfield JE. Four decades of Fontan palliation. Nat Rev Cardiol. 2010;7(9):520-7.
Naranjo AM, Selman-Housein E, Marcano L, González A, Rivera KM, Carballés F. Dos décadas de la cirugía del corazón univentricular en Cuba. Rev Cubana Cardiol Cir Cardiovasc [Internet]. 2012[citado 2013Dic21];18(4):186-9. Disponible en: http://www.revcardiologia.sld.cu/index.php/revcardiologia/article/view/257/302
Naranjo A, Casanova R, Savío A, Selman-Housein E, Palenzuela H, Machado O, et al. Guía para la actuación asistencial. Departamento de Cirugía Cardiovascular. Cardiocentro Pediátrico "William Soler". [Internet]. La Habana: Sociedad Cubana de Cirugía; 2007[citado 2013 Dic 21] Disponible en: http://www.sld.cu/galerias/pdf/uvs/cirured/guia_de_actuacion_asistencial_ccvped.pdf
Kotani Y, Kasahara S, Fujii Y, Yoshizumi K, Oshima Y, Otsuki S, et al. Clinical outcome of the Fontan operation in patients with impaired ventricular function. Eur J Cardiothorac Surg. 2009;36(4):683-7.
Abella IT, Torres IV, Sardella A, Kreutzer C, Conejeros W, Kreutzer GO, et al. Ergometría en pacientes con bypass total de ventrículo venoso con tubo extracardíaco. Rev Argent Cardiol. 2007;75(6):450-5.
Mendes M. General principles of exercise testing in cardiac rehabilitation. En: Niebauer J, Editor. Cardiac Rehabilitation Manual. Londres: Springer-Verlag London Limited, 2011; p. 3-30.
World Medical Association. WMA Declaration of Helsinki - Ethical principles for medical research involving human subjects. 59th WMA General Assembly, Seoul, October 2008; [Internet] [citado 2013 Dic 26]. Disponible en: http://www.wma.net/en/30publications/10policies/b3
Rydberg A, Wiklund U, Rask P, Hörnsten R. Serial assessment of variability in heart rate in children with the Fontan circulation. Cardiol Young. 2005;15(5):498-503.
Backer CL, Deal BJ, Kaushal S, Russell HM, Tsao S, Mavroudis C. Extracardiac versus intra-atrial lateral tunnel Fontan: extracardiac is better. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2011;14(1):4-10.
Van Hare GF. On the evolution of the Fontan operation: from an electrophysiologist´s perspective. J Am Coll Cardiol. 2010;56(11):897-8.
Kumar SP, Rubinstein CS, Simsic JM, Taylor AB, Saul JP, Bradley SM. Lateral tunnel versus extracardiac conduit Fontan procedure: a concurrent comparison. Ann Thorac Surg. 2003;76(5):1389-96.
Zhao QY, Huang H, Tang YH, Wang X, Okello E, Liang JJ, et al. Relationship between autonomic innervation in crista terminalis and atrial arrhythmia. J Cardiovasc Electrophysiol. 2009;20(5):551-7.
Khairy P, Poirier N. Is the extracardiac conduit the preferred Fontan approach for patients with univentricular hearts? The extracardiac conduit is not the preferred Fontan approach for patients with univentricular hearts. Circulation. 2012;126(21):2516-25.
Stephenson EA, Lu M, Berul CI, Etheridge SP, Idriss SF, Margossian R, et al. Arrhythmias in a contemporary Fontan cohort: prevalence and clinical associations in a multicenter cross-sectional study. J Am Coll Cardiol. 2010;56(11):890-6.
Yap SC, Harris L, Downar E, Nanthakumar K, Silversides CK, Chauhan VS. Evolving electroanatomic substrate and intra-atrial reentrant tachycardia late after Fontan surgery. J Cardiovasc Electrophysiol. 2012;23(4):339-45.
Ono M, Boethig D, Goerler H, Lange M, Westhoff-Bleck M, Breymann T. Clinical outcome of patients 20 years after Fontan operation - effect of fenestration on late morbidity. Eur J Cardiothorac Surg. 2006;30(6):923-9.
Robbers-Visser D, Miedema M, Nijveld A, Boersma E, Bogers AJ, Haas F, et al. Results of staged total cavopulmonary connection for functionally univentricular hearts; comparison of intra-atrial lateral tunnel and extracardiac conduit. Eur J Cardiothorac Surg. 2010;37(4):934-41.
Nürnberg JH, Ovroutski S, Alexi-Meskishvili V, Ewert P, Hetzer R, Lange PE. New onset arrhythmias after the extracardiac conduit Fontan operation compared with the intraatrial lateral tunnel procedure: early and midterm results. Ann Thorac Surg. 2004;78(6):1979-88.
Chowdhury UK, Airan B, Kothari SS, Talwar S, Saxena A, Singh R, et al. Specific issues after extracardiac Fontan operation: ventricular function, growth potential, arrhythmia, and thromboembolism. Ann Thorac Surg. 2005;80(2):665-72.
Sinha P, Zurakowski D, He D, Yerebakan C, Freedenberg V, Moak JP, et al. Intra/extracardiac fenestrated modification leads to lower incidence of arrhythmias after the Fontan operation. J Thorac Cardiovasc Surg. 2013;145(3):678-82.
Kerendi F, Kramer ZB, Mahle WT, Kogon BE, Kanter KR, Kirshbom PM. Perioperative risks and outcomes of atrioventricular valve surgery in conjunction with Fontan procedure. Ann Thorac Surg. 2009;87(5):1484-8.
Choussat A, Fontan F, Besse P, Vallot F, Chauve A, Bricaud H. Selection criteria for Fontan procedure. En: Anderson RH, Shinebourne EA, eds. Pediatric Cardiology. Edinburgh: Churchill Livingstone, 1977; p. 559-66.
Brown JW, Ruzmetov M, Deschner BW, Rodefeld MD, Turrentine MW. Lateral tunnel Fontan in the current era: is it still a good option? Ann Thorac Surg. 2010;89(2):556-62; discussion 562-3.
Brancaccio G, Gandolfo F, Carotti A, Amodeo A. Ventricular assist device in univentricular heart physiology. Interact Cardiovasc Thorac Surg. 2013;16(4):568-9.
Aboulhosn J, Williams R, Shivkumar K, Barkowski R, Plunkett M, Miner P, et al. Arrhythmia recurrence in adult patients with single ventricle physiology following surgical Fontan conversion. Congenit Heart Dis. 2010;5(5):430-4.
Menon S, Dearani JA, Cetta F. Long-term outcome after atrioventricular valve surgery following modified Fontan operation. Cardiol Young. 2011;21(1):83-8.
Jang WS, Kim WH, Choi K, Lee JR, Kim YJ, Kwon BS, et al. What factors predict long-term survival and valve durability in patients with atrioventricular valve regurgitation in single-ventricle physiology? Pediatr Cardiol. 2013;34(6):1366-73.
Gérelli S, Boulitrop C, Van Steenberghe M, Maldonado D, Bojan M, Raisky O, et al. Bidirectional cavopulmonary shunt with additional pulmonary blood flow: a failed or successful strategy? Eur J Cardiothorac Surg. 2012;42(3):513-9.
Milanesi O, Stellin G, Colan SD, Facchin P, Crepaz R, Biffanti RR, et al. Systolic and diastolic performance late after the Fontan procedure for a single ventricle and comparison of those undergoing operation at <12 months of age and at >12 months of age. Am J Cardiol. 2002;89(3):276-80.
Klimes K, Ovroutski S, Abdul-Khaliq H, Ewert P, Alexi-Meskishvili V, Kuehne T, et al. Exercise capacity reflects ventricular function in patients having the Fontan circulation. Cardiol Young. 2009;19(4):340-5.
Nakamura Y, Yagihara T, Kagisaki K, Hagino I, Kobayashi J. Ventricular performance in long-term survivors after Fontan operation. Ann Thorac Surg. 2011;91(1):172-80.
Ohuchi H, Ono S, Tanabe Y, Fujimoto K, Yagi H, Sakaguchi H, et al. Long-term serial aerobic exercise capacity and hemodynamic properties in clinically and hemodynamically good, "excellent", Fontan survivors. Circ J. 2012;76(1):195-203.
Iwai S, Kawata H, Ozawa H, Yamauchi S, Kishimoto H. Use of the Damus-Kaye-Stansel procedure prevents increased ventricular strain in Fontan candidates. Eur J Cardiothorac Surg. 2013;43(1):150-4.
La Gerche A, Gewillig M. What limits cardiac performance during exercise in normal subjects and in healthy Fontan patients? Int J Pediatr [Internet]. 2010 [citado 2013Dic21];2010:791291. [aprox. 8p] Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2943078/
Ovroutski S, Ewert P, Miera O, Alexi-Meskishvili V, Peters B, Hetzer R, et al. Long-term cardiopulmonary exercise capacity after modified Fontan operation. Eur J Cardiothorac Surg. 2010;37(1):204-9.
McCrindle BW, Williams RV, Mital S, Clark BJ, Russell JL, Klein G, et al. Physical activity levels in children and adolescents are reduced after the Fontan procedure, independent of exercise capacity, and are associated with lower perceived general health. Arch Dis Child. 2007;92(6):509-14.
Anderson PA, Sleeper LA, Mahony L, Colan SD, Atz AM, Breitbart RE, et al. Contemporary outcomes after the Fontan procedure: a Pediatric Heart Network multicenter study. J Am CollCardiol. 2008;52(2):85-98.
Longmuir PE, Russell JL, Corey M, Faulkner G, McCrindle BW. Factors associated with the physical activity level of children who have the Fontan procedure. Am Heart J. 2011;161(2):411-7.
Recibido: 29 de diciembre de 2013
Aceptado: 23 de enero de 2014
Subir






















