CorSalud 2014 Ene-Mar;6(1):79-85
ARTÍCULO ESPECIAL
EL INTERVALO QT, SU ORIGEN E IMPORTANCIA DEL CONOCIMIENTO DE FÓRMULAS PARA SU MEDICIÓN EN DIFERENTES CIRCUNSTANCIAS CLÍNICAS
The QT interval, its origin and importance of the knowledge of formulas for its measurement in different clinical circumstances
MSc. Dr. Elibet Chávez González
______________
Servicio de Electrofisiología Cardíaca Clínica y Estimulación. Cardiocentro "Ernesto Che Guevara". Villa Clara, Cuba.
Correspondencia: E. Chávez González. Calle 1ra e/ Unión y Río, Reparto Ramón Ruiz del Sol. Santa Clara, CP 50100. Villa Clara, Cuba. Correo electrónico: elibet@capiro.vcl.sld.cu
Resumen
El síndrome de QT largo es una canalopatía arritmogénica caracterizada por una grave alteración en la repolarización ventricular, traducida electrocardiográficamente por una prolongación del intervalo QT. La implicación de varios canales iónicos en la génesis del potencial de acción cardíaco hace que las alteraciones de estructura y función de ellos conlleven al llamado síndrome y a la presencia de arritmias ventriculares malignas. En 1920, Bazett adaptó la fórmula de la duración de la sístole eléctrica del corazón al intervalo QT del electrocardiograma, y propuso valores normales del QT para una determinada frecuencia cardíaca. Después de esta descripción, varias fueron las fórmulas descritas en diferentes situaciones clínicas para el cálculo del intervalo QT corregido. Es de vital importancia, para el uso clínico, el conocimiento sobre cómo medir el intervalo QT y de su corrección, como herramienta para el diagnóstico de afecciones arritmogénicas y la prevención de arritmias ventriculares malignas primarias o secundarias.
Palabras clave: Intervalo QT, Fórmulas de medición
Abstract
The long QT syndrome is an arrhythmogenic channelopathy characterized by severe alterations in ventricular repolarization, electrocardiographically translated as a QT interval prolongation. The involvement of various ion channels in the genesis of cardiac action potential causes that alterations in their structure and function lead to the so-called syndrome and to the presence of malignant ventricular arrhythmias. In 1920, Bazett adapted the formula of the cardiac electrical systole duration to the QT interval of the electrocardiogram, and proposed normal values of QT for a given heart rate. After Bazett´s description, several formulas were described in different clinical situations to calculate the corrected QT interval. The knowledge about how to measure the QT interval and about its correction as a tool for the diagnosis of arrhythmogenic conditions and prevention of primary or secondary malignant ventricular arrhythmias is of vital importance for its clinical use.
Key words: : QT interval, QT interval measurement
Introducción
El síndrome de QT largo (SQTL) es una canalopatía arritmogénica caracterizada por una grave alteración en la repolarización ventricular, traducida electrocardiográficamente por una prolongación del intervalo QT1, que predispone a muerte súbita por arritmias ventriculares malignas del tipo de taquicardia helicoidal (torsades de pointes en su idioma original).
A 11 años de identificar los principales canales afectados en esta enfermedad, se han descrito cientos de mutaciones distribuidas en hasta ahora 10 genes relacionados con el síndrome. El escrutinio genético realizado desde entonces ha mostrado que, si bien la forma grave de la enfermedad es esporádica, hay polimorfismos comunes en los genes relacionados con esta afección, que pueden generar susceptibilidad individual al desarrollo de taquicardia helicoidal, en particular con el uso de determinados fármacos; más aún, se han identificado polimorfismos con cualidades reguladoras que también pueden exacerbar o silenciar la gravedad de una mutación. El entendimiento de los procesos moleculares de la enfermedad ha permitido optimizar el tratamiento, mejorar la supervivencia de los afectados, y generar así una importante correlación genotipo-fenotipo-tratamiento.
A pesar de los avances, una cuarta parte de los casos no tiene mutaciones en los genes descritos hasta el momento, por lo que el SQTL continúa siendo motivo de investigación1. El presente trabajo tiene como objetivo resumir las bases de la repolarización ventricular (intervalo QT) y la importancia de su medición en diferentes situaciones clínicas.
Márquez2, plantea que en su criterio “el término de canalopatía, traducido desde el inglés, puede resultar fuerte”. Preferentemente lo llamaría “enfermedad de los canales iónicos”, si se considera que la base de esta enfermedad radica en la presencia de alteraciones a nivel de los canales iónicos, responsables del equilibrio entre la entrada y salida de estos durante la despolarización y repolarización ventriculares. En cuanto a este último concepto, el propio Márquez2 plantea que desde el punto de vista electrocardiográfico, la repolarización ventricular normal está representada por el segmento ST y la onda T. Sin embargo, el parámetro electrocardiográfico con el que se cuenta para valorar la duración de la repolarización es el intervalo QT. Es importante recordar que dicho intervalo comprende no sólo a la repolarización, sino también a la despolarización ventricular, ya que incluye al complejo QRS. Este hecho es fundamental para comprender por qué se puede alargar en presencia de trastornos de la conducción, y no sólo por alteraciones de la repolarización.
Algunas bases iónicas de la repolarización ventricular
La repolarización ventricular normal se produce por el equilibro entre las corrientes de entrada de sodio (Na+) y calcio (Ca+), y la corrientes de salida de potasio (K+). Éstas últimas son varias pero se pueden agrupar en dos, las encargadas de la repolarización en la fase inicial del potencial de acción, que se denominan ‘corrientes hacia afuera’ (transient outward, en inglés: ITO) y aquellas encargadas del resto de la repolarización que se conocen como corrientes ‘rectificadoras tardías’ (Ikr, Iks, IKur). Existen diversas mutaciones que pueden afectar a los canales iónicos y sus efectos se pueden agrupar en tres: afección de la permeabilidad del canal, alteración de su activación y disfunción en su inactivación.
Anton Jervell y Fred Lange-Nielsen3, en 1957, describen por primera vez una familia con 6 hijos, 4 de los cuales tenían sordera congénita y episodios sincopales, 3 de ellos tuvieron muerte súbita. El electrocardiograma (ECG) de los casos mostraba un intervalo QT inusualmente largo. Ambos progenitores estaban asintomáticos, tenían un ECG normal y no presentaban problemas de audición. En 1963, Romano4 y Ward publicaron de forma independiente un síndrome cardíaco familiar caracterizado por síncope recurrente, antecedente familiar de muerte súbita y prolongación del intervalo QT sin sordera neuronal. De estos hallazgos descritos anteriormente salió la clasificación del SQTL en homocigótico y heterocigótico; sin embargo, la complejidad molecular de los canales iónicos y el estudio genético ha permitido establecer una clasificación con énfasis en los trastornos genéticos.
Los canales iónicos son proteínas transmembranales encargadas de transportar iones a través de la membrana celular; los canales implicados en el SQTL son selectivos o especializados en el transporte de un solo ión y dependientes de voltaje, es decir, su activación ocurre a determinado voltaje intracelular, que varía según el subtipo de canal. Los fenómenos eléctricos y contráctiles que suceden en el miocardiocito son controlados por estas estructuras. Los canales iónicos forman complejos macromoleculares, hay una unidad principal formadora del poro del canal y proteínas auxiliares que lo regulan. La afección en la función de un canal en el SQTL puede ocurrir en dos sitios: en la proteína principal o en las proteínas reguladoras.
La afección en la unidad formadora del poro, conocida como alfa, genera los 3 subtipos más comunes de SQTL: SQTL1 (afección en el canal de potasio IKs), SQTL2 (afección en el canal de potasio IKr) y SQTL3 (afección en el canal de sodio INa). Al ser los más frecuentes, han sido mejor caracterizados desde los puntos de vista clínico y genético. El llamado síndrome de Jervell-Lange-Nielsen corresponde en la actualidad a las variedades de SQTL 1 y 5. De manera característica, los pacientes presentan sordera congénita y tienen mutaciones homocigotas o heterocigotas compuestas que afectan a la corriente IKs. El síndrome de Romano Ward abarca desde la variedad SQTL 1 hasta la 10 y no se manifiesta con sordera1. Describir clínicamente los 10 genotipos de SQTL, no es objetivo de este artículo, se remite al lector al trabajo de Medeiros et al.1, donde se detallan cada uno de ellos.
Origen de las fórmulas para la medición del QT
Es importante preguntarnos ¿cómo se mide el intervalo QT y cuándo es normal?
La duración de la sístole mecánica fue un tópico de mucho interés entre los pioneros de la fisiología cardiovascular del siglo XIX. Según plantean Cobos y García5, A. D. Waller, hoy famoso por su contribución al nacimiento de la electrocardiografía, propuso en 1891 la siguiente expresión para la duración normal de la sístole: sístole mecánica = K x RR1/2, donde K tiene un valor de 0,343. En 1920, Bazett no hizo más que adaptar esta fórmula a la duración de la sístole eléctrica del corazón, el intervalo QT, y propuso que su valor normal para una determinada frecuencia cardíaca es K x RR1/2, donde K es 0,37 para el varón y 0,4 para la mujer5. Así, para determinar si un paciente concreto tiene un intervalo QT normal, su QT debe compararse con el QT ideal derivado de la fórmula original de Bazett. Este QT ideal es el que puede leerse en las populares reglas de electrocardiogramas. Posteriormente a la expresión de Bazett, los olvidados L.M. Taran y N. Szilagyi, según Cobos y García5, propusieron una fórmula de la cual emergió el concepto de intervalo QT corregido, que es el intervalo QT que un determinado paciente tendría, teóricamente, a una frecuencia de 60 latidos por minuto. Por lo tanto, la expresión que hoy se usa, y que se atribuye erróneamente a Bazett, se la debemos a L.M. Taran y N. Szilagyi5. En textos clásicos de los años sesenta, el papel de estos autores aparece claramente reconocido y se habla del «intervalo QT corregido de Taran y Szilagyi o fórmula de Bazett modificada por Taran y Szilagyi5».
Considerada la fórmula como QT corregido (QTc) = QT medido/RR1/2, es interesante saber que tan solo con ella no se puede calcular el QTc para las diferentes situaciones clínicas que se encuentran en la práctica médica. Existen diferentes modelos matemáticos que describen la relación entre el intervalo QT y el ritmo cardíaco. La relación entre el intervalo RR y el QT es curvilínea. Hay diversidad de formas matemáticas que modelan la relación entre el intervalo QT y el RR. Existen modelos de tipo parabólico, polinomio, lineal, hiperbólico, exponencial, formas de tablas y nomogramas6:
Lineal: QTc = QT + x (1 – RR)
Hiperbólico: QTc = QT + x (1/RR – 1)
Parabólico: QTc = QT/RRx
Logarítmico: QTc = QT – x ln(RR)
Logarítmico modificado: QTc = ln(exp(QT) + x (1 – RR))
Exponencial: QTc = QT + x (e–RR – 1/e)
Arco-tangente: QTc = QT + x (arctg(1.0) – arctg(RR))
Arco-coseno hiperbólico QTc = QT + x (ln(2+30,5) – arccosh(RR+1))
“ln” es logaritmo neperiano, “exp” es la función exponencial en base al número e=2,718.
Para optimizar cada fórmula se debe encontrar el parámetro “x” al resolver la ecuación de relación r (RR, QTc(x)) = 0.
A partir de dichos modelos se derivaron diferentes fórmulas: Bazett 1920, Fridericia 1920, Mayeda 1934, Adams 1936, Larsen y Skulason 1941, Ashman 1942, Schlamowitz 1946, Ljung 1949, Simonson 1962, Boudolas 1981, Rickards 1981, Hodges 1983, Kawataki 1984, Sarma 1984, Kovacs 1985, Van de Water 1989, Lecocq 1989, Rautaharju 1990, Todt 1992, Sagie (Framingham) 1992, Arrowood 1993, Yoshinaga 1993, Wohlfart 1994, Klingield 1995, Hodges 1997 y Matsunaga 19976.
La presentación de los modelos matemáticos y de las fórmulas del QTc presentadas no tiene como objetivo atiborrar al lector en cuanto al conocimiento de sus orígenes, ni de las propias fórmulas, pero sí se pretende que se perciba lo complejo del tema. Muchas veces se obvia o se realiza mal la medición del QT; sin embargo, el SQTL es conocido por clínicos y cardiólogos, que quizás evaden la medida de este intervalo y su corrección porque a veces no es sencilla. Viskin et al.7, describieron que menos del 40 % de los médicos no cardiólogos, menos del 50 % de los cardiólogos y más del 80 % de los electrofisiólogos, supieron medirlo correctamente.
Algunas fórmulas para el cálculo del QTc6 se muestran en la tabla.
Tabla. Fórmulas para calcular el QTc.
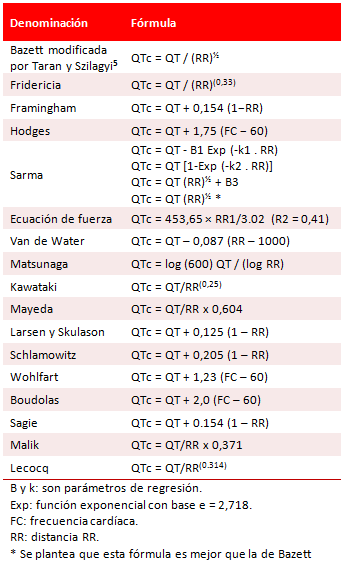
La utilidad de tantas fórmulas está dada por sus usos en diferentes circunstancias clínicas. El bloqueo nervioso simpático y parasimpático puede realizarse con propanolol y atropina. La combinación bipedestación + atropina es una actividad puramente del sistema nervioso simpático, la combinación decúbito supino + propranolol es actividad pura del sistema nervioso parasimpático8. Para estos cambios posturales, la corrección de Hodges mostró incrementos y decrementos del QTc para el suministro de atropina y propranolol, respectivamente. La corrección individual se adaptaría mejor a los cambios dinámicos del RR, que inevitablemente afectan a la hora de corregir el intervalo QT de forma adecuada9. En referencia al sistema nervioso autónomo es importante recordar la utilidad de la adrenalina para desenmascarar la presencia de SQTL, fundamentalmente para los tipos 1 y 2. Es particularmente eficaz para detectar formas asintomáticas de SQTL1 (sensibilidad, especificidad, valor predictivo positivo y negativo de 92,5, 86, 76 y 96 %, respectivamente). Puede ser útil también en el diagnóstico del SQTL2, con menores sensibilidad y especificidad. No es útil para el SQTL3 u otras formas de SQTL. En condiciones normales, la estimulación simpática induce la fosforilación del canal de potasio IKs, optimiza su función y da lugar a un acortamiento del potencial de acción. En pacientes con SQTL, en particular el tipo 1, se observa una respuesta paradójica a la administración de dosis bajas de adrenalina (0,025 – 0,2 µg/kg/min), que alargan el intervalo QT más de 30 ms10-13.
Las fórmulas de Fridericia o Framingham, han mostrado ser más útiles para la determinación del QTc al minuto después del máximo ejercicio, con las cuales se ha podido probar que son superiores en establecer el SQTL cuando se compara con las fórmulas de Bazett y Hodges14.
Durante el sueño, en pacientes jóvenes, como en ellos existe una frecuencia cardíaca alta, las fórmulas de Hodges y Bazett sobrecorrigen el QTc, y las fórmulas de Framingham y Fridericia, las infraestiman. Sin embargo, la de Hodges tiene la mejor aproximación en la etapa del sueño15.
El método del nomograma para la corrección del intervalo QT es más preciso que los otros tres métodos: Bazett, Fridericia y Framingham. Con frecuencias cardíacas entre 60 y 100 latidos/minutos, la ecuación de regresión lineal es:
QT = 237 + 0.158 x RR (P < 0,001)16
Cuando se utiliza un Holter de 24 horas en sujetos sanos no se encuentra diferencia significativa entre los valores del QTc entre diferentes fórmulas17.
Consideraciones para la medición del intervalo QT6
Registrar el ECG en condiciones basales y en reposo, y evitar el período posprandial.
Estar unos minutos de reposo antes de hacer el ECG, para permitir que el intervalo QT se adapte a la frecuencia cardíaca (tarda 1-3 minutos).
El intervalo QT debe medirse:
De forma manual, preferiblemente usando las derivaciones de los miembros que muestran mejor el final de la onda T.
Desde el principio del complejo QRS hasta el final de la onda T, haciendo la medida en 3-5 latidos. La onda U posiblemente corresponda a la repolarización tardía de células del miocardio medio y debe incluirse en la medida, si es lo suficientemente ancha para estar unida a la onda T. Al realizar mediciones, a menudo se encuentra que el final de la onda T no es clara, en tales casos el final de esta onda debe ser determinada por extrapolación con el uso del método de la tangente18.
La medición del intervalo QT debe ajustarse a la frecuencia cardíaca, lo que se llama intervalo QTc. Esta corrección sirve para independizarlo de la frecuencia cardíaca de cada individuo y transformarlo en una medida de la actividad eléctrica comparable entre pacientes sanos y enfermos.
La mejor forma de determinar el QTc aún no ha sido lograda porque los estudios realizados no son prospectivos. Algunos autores aseguran que la fórmula de Framingham es el modo más idóneo desde el punto de vista epidemiológico, basada en datos empíricos obtenidos de grandes muestras poblacionales.
Evitar medir el intervalo QT en los ciclos cardíacos con gran variación en el intervalo sinusal o en los precedidos por arritmias.
Puede hacerse una prueba de esfuerzo para descartar una prolongación acentuada del QT durante la fase de recuperación.
La medida del intervalo QT es particularmente cambiante si el paciente está en fibrilación auricular, porque el intervalo QT varía de latido a latido en dependencia de los diferentes intervalos RR.
El QTc se alarga con la edad, es más largo en mujeres adultas que en varones de la misma edad, y el QTc más largo se halla poco después del despertar.
¿Cuándo es normal el intervalo QTc?
Se ha planteado que el intervalo QT debe medirse de manera preferente en las derivaciones DII o V5, donde se ha documentado que tiene mayor poder predictivo. Traduce la duración de la repolarización ventricular y se mide desde el inicio de la onda Q hasta el final de la onda T. Convencionalmente, se utiliza la fórmula de Bazett para corregir la duración del intervalo de acuerdo con la frecuencia cardíaca (QTc = QT/RR½, expresado en segundos). Es aconsejable que el médico realice una medición manual y no confiar en las mediciones automatizadas que, si bien son útiles para otros intervalos, suelen ser imprecisas en el cálculo del intervalo QT, este es un intervalo dinámico y los límites normales dependen de varios factores. Si bien se ha considerado anormal un intervalo QTc ≥ 440 ms en los varones y ≥ 460 ms en las mujeres, en este rango podemos encontrar tanto a portadores de mutaciones como a sujetos sanos. En familias con SQTL1, ningún caso con genotipo positivo tiene un QTc < 410 ms, y ninguno con genotipo negativo tiene un QTc > 470 ms. Un QTc > 440 ms es eficaz para detectar a pacientes con mutaciones asociadas SQTL, un QTc > 470 ms es útil para detectar a pacientes en riesgo de desarrollar síntomas, y un QTc > 500 ms se ha encontrado en pacientes sintomáticos en tratamiento6.
Como se ha mencionado, la medición del QT incluye la duración del QRS, por lo tanto en presencia de bloqueos de rama, donde los valores de duración del QRS se encuentran incrementados con respecto a su valor normal, se produce un incremento en el intervalo QT. En ocasiones se obvia la medición del QT si la duración del QRS es ≥ 120 ms. En estas circunstancias el intervalo JT (medición desde el punto J hasta el final de la onda T) es más apropiado que el QT como medida de repolarización ventricular19. El intervalo JT es independiente de la duración del QRS y representa un mejor índice de la repolarización ventricular20.
Por último, se debe mencionar que tan importante como medir el QT, es observar las variaciones de la onda T (macro y microalternancias), estas variaciones están relacionadas con alteraciones en la repolarización, que varían latido a latido, y ocasionan sus cambios sucesivos. En pacientes con SQTL, se ha observado mayor presencia de macroalternancia de T, previo a episodios de taquicardia helicoidal21-23, aunque otros estudios no han demostrado esta relación24. En pacientes con SQTL, durante el día, es más fácil observar la macroalternancia de la onda T, quizás relacionado con las variaciones autonómicas del ritmo circadiano. A pesar de haberse descrito la presencia de esta macroalternancia previo a los episodios de taquicardia helicoidal, que pudiera constituir un signo de alarma, no se han descrito diferencias significativas en la macroalternancia de T en pacientes con SQTL sintomáticos y asintomáticos, y tampoco entre pacientes bajo tratamiento con betabloqueadores o sin ellos. Las variaciones latido a latido de la onda T están relacionadas con variaciones del potencial de acción en sus corrientes iónicas25,26.
Conclusiones
La medición y cálculo del intervalo QTc puede constituir un reto para la práctica clínica diaria. Es de vital importancia para su uso clínico el conocimiento sobre cómo medir el intervalo QT y su corrección, como herramienta para el diagnóstico de afecciones arritmogénicas y la prevención de arritmias ventriculares malignas primarias o secundarias.
Referencias bibliográficas
Medeiros-Domingo A, Iturralde-Torres P, Ackerman MJ. Clínica y genética en el síndrome de QT largo. Rev Esp Card. 2007;60(7):739-52.
Márquez MF. El síndrome de QT largo: una breve revisión del diagnóstico electrocardiográfico incluyendo la prueba de Viskin. Arch Cardiol Mex. 2012;82(3):243-7.
Jervell A, Lange-Nielsen F. Congenital deaf-mutism, functional heart disease with prolongation of the Q-T interval and sudden death. Am Heart J. 1957;54:59-68.
Romano C, Gemme G, Pongiglione R. Rare cardiac arrhythmias of the pediatric age. I. Repetitive paroxysmal tachycardia. Minerva Pediatr. 1963;15:1155-64.
Cobos MA, García JC. ¿Quién fue el autor de la fórmula de Bazett? Rev Esp Cardiol. 2008;61(8):892-8.
Lanza Tarricone G. Fórmulas para el QT corregido y consideraciones clínicas. Gac Méd Caracas. 2008;116(3):224-34.
Viskin S, Rosovski U, Sands AJ, Chen E, Kistler PM, Kalman JM, et al. Inaccurate electrocardiographic interpretation of long QT: the majority of physicians cannot recognize a long QT when they see one. Heart Rhythm. 2005;2(6):569-74.
Saul J, Berger RD, Albrecht P, Stein S, Chen MH, Cohen RJ. Transfer function analysis of the circulation: Unique insights into cardiovascular regulation. Am J Physiol. 1991;261(4 Pt 2):H1231-45.
Llamedo M, Soria L, Arini PD, Risk MR, Laguna P. Evaluación de la corrección del intervalo QT durante bloqueo del sistema nervioso autónomo y cambios posturales. XV Congreso Argentino de Bioingeniería. Paraná, ER. Argentina; 21-23 Septiembre 2005.
Ackerman MJ, Khositseth A, Tester DJ, Hejlik JB, Shen WK, Porter CB. Epinephrine-induced QT interval prolongation: a gene-specific paradoxical response in congenital long QT syndrome. Mayo Clin Proc. 2002;77(5):413-21.
Khositseth A, Hejlik J, Shen WK, Ackerman MJ. Epinephrine-induced T-wave notching in congenital long QT syndrome. Heart Rhythm. 2005;2(2):141-6.
Shimizu W, Noda T, Takaki H, Nagaya N, Satomi K, Kurita T, et al. Diagnostic value of epinephrine test for genotyping LQT1, LQT2, and LQT3 forms of congenital long QT syndrome. Heart Rhythm. 2004;1(3):276-83.
Vyas H, Hejlik J, Ackerman MJ. Epinephrine QT stress testing in the evaluation of congenital long-QT syndrome: diagnostic accuracy of the paradoxical QT response. Circulation. 2006;113(11):1385-92.
Benatar A, Decraene T. Comparison of formulae for heart rate correction of QT interval in exercise ECGs from healthy children. Heart. 2001;86(2):199-202.
Benatar A, Ramet J, Decraene T, Vandenplas Y. QT interval in normal infants during sleep with concurrent evaluation of QT correction formulae. Med Sci Monit. 2002;8(5):CR351-6.
Dogan A, Tunc E, Varol E, Ozaydin M, Ozturk M. Comparison of the four formulas of adjusting QT interval for the heart rate in the middle-aged healthy Turkish men. Ann Noninvasive Electrocardiol. 2005;10(2):134-41.
Molnar J, Weiss J, Zhang F, Rosenthal JE. Evaluation of five QT correction formulas using a software-assisted method of continuous QT measurement from 24-hour Holter recordings. Am J Cardiol. 1996;15;78(8):920-6.
Drezner JA, Ackerman MJ, Cannon BC, Corrado D, Heidbuchel H, Prutkin JM, et al. Abnormal electrocardiographic findings in athletes: recognising changes suggestive of primary electrical disease. Br J Sports Med. 2013;47(3):153-67.
Spodick DH. Reduction of QT-interval imprecision and variance by measuring the JT interval. Am J Cardiol. 1992;70(1):103.
Das G. QT interval and repolarization time in patients with intraventricular conduction delay. J Electrocardiol. 1990;23(1):49-52.
Zareba W, Moss AJ, le Cessie S, Hall WJ. T wave alternans in idiopathic long QT syndrome. J Am Coll Cardiol. 1994;23(7):1541-6.
Armoundas AA, Nanke T, Cohen RJ. T-wave alternans preceding torsade de pointes ventricular tachycardia. Circulation. 2000;101(21):2550.
Goldman DS, Zareba W, Moss AJ. Malignant T-wave alternans. Circulation. 2000;102(8):E46-7.
Narayan SM. T-wave alternans and the susceptibility to ventricular arrhythmias. J Am Coll Cardiol. 2006;47(2):269-81.
Hohnloser SH. Macroscopic T wave alternans as a harbinger of sudden death. J Cardiovasc Electrophysiol. 1999;10(4):625.
Grabowski M, Karpinski G, Filipiak KJ, Opolski G. Drug-induced long-QT syndrome with macroscopic T-wave alternans. Circulation. 2004;110(18):e459-60.
Subir






















