CorSalud 2014 Ene-Mar;6(1):47-55
ARTÍCULO ORIGINAL
COMPORTAMIENTO DE LA ENDOCARDITIS INFECCIOSA EN EL CARDIOCENTRO PEDIÁTRICO "WILLIAM SOLER" DE 2000 A 2012
Dr. Hiram Tápanes Daumya, Dra. Elsa Fleitas Ruisáncheza, Dr. Eliobert Díaz Bertota, Dr. Andrés Savío Benavidesa y Dra. Maylín Peña Fernándezb
______________
Cardiocentro Pediátrico "William Soler", La Habana Cuba.
Hospital Pediátrico "Juan Manuel Márquez", La Habana Cuba.
Correspondencia: H. Tápanes Daumy. Ave 43 N° 1418, Esquina Calle 18. 11900. La Habana, Cuba.
Correo electrónico: hiramtapanes@infomed.sld.cu
Resumen
Introducción: La endocarditis infecciosa es una enfermedad poco frecuente en niños. Existen escasas comunicaciones que incluyan gran número de enfermos y analicen sus factores de riesgo. Objetivo: Describir las características clínico-epidemiológicas de la endocarditis infecciosa pediátrica. Método:Se realizó un estudio observacional descriptivo retrospectivo en los 33 pacientes ingresados por endocarditis infecciosa (que cumplían los Criterios de Duke), en el Cardiocentro Pediátrico "William Soler" de La Habana, Cuba, desde enero de 2000 a julio de 2012. Se revisaron las historias clínicas para obtener el dato primario. Las variables fueron almacenadas y analizadas con el paquete estadístico SPSS versión 15.0. Se determinaron frecuencias absolutas y relativas y para la asociación de las variables cualitativas se empleó el estadígrafo X2 de independencia. Resultados: La endocarditis infecciosa predominó en escolares de sexo femenino (20/33 pacientes), las cardiopatías más frecuentes fueron la comunicación interventricular (50 %) y la tetralogía de Fallot (18,2 %). Los procedimientos odontológicos (36,4 % p < 0.01) y el uso de catéteres intravasculares (36.4 % p < 0.05) fueron los factores de riesgo de mayor relevancia. En 78,8 % de los casos la forma de presentación fue subaguda y en 57,6 %, nosocomial. En 25 de los 33 pacientes los hemocultivos resultaron positivos y en 14 de ellos (56 %) se aislaron especies de Staphylococcus. Se registraron 46 complicaciones, 30,4 % correspondió a insuficiencia cardíaca congestiva, seguida de embolismo cerebral (21,8 %), pulmonar y neumonía (10,9 %). Conclusiones: La endocarditis infecciosa fue más frecuente en niños con cardiopatías congénitas, y se asoció significativamente a factores de riesgo definidos, tuvo una presentación clínica subaguda y la adquisición del germen fue nosocomial. Los gérmenes más aislados fueron especies estafilocócicas y entre las complicaciones prevalecieron la insuficiencia cardíaca y los cardioembolismos.
Palabras clave: Endocarditis infecciosa, Edad pediátrica, Epidemiología, Diagnóstico, Complicaciones
Behavior of infective endocarditis at the Pediatric Cardiocentro William Soler from 2000-2012
Abstract
Introduction: Infective endocarditis is a rare disease in children. There are few publications that include large numbers of patients and discuss their risk factors. Objective: To describe the clinical and epidemiological characteristics of pediatric infective endocarditis. Method: A retrospective descriptive study was performed in the 33 patients admitted for infective endocarditis (who met the Duke criteria) at the Pediatric Cardiocentro William Soler in Havana, Cuba, from January 2000 to July 2012. Medical records were reviewed to obtain the primary data. Variables were stored and analyzed with SPSS version 15.0. Absolute and relative frequencies were determined and for the association between qualitative variables the Chi Square Test of Independence was used. Results: Infective endocarditis predominated in female students (20/ 33 patients), the most frequent heart diseases were ventricular septal defect (50%) and tetralogy of Fallot (18.2%). Dental procedures (36.4% p < 0.01) and the use of intravascular catheters (36.4 % p < 0.05) were the most relevant risk factors. In 78.8 % of cases the presentation was subacute and in 57.6 %, nosocomial. Blood cultures were positive in 25 of 33 patients; in 14 of them (56 %) staphylococcal species were isolated. 46 complications were found, 30.4 % were congestive heart failure, followed by cerebral (21.8%) and lung embolisms, and pneumonia (10.9%). Conclusions: Infective endocarditis was more frequent in children with congenital heart disease, and was significantly associated with defined risk factors, had a subacute clinical presentation and germ acquisition was nosocomial. Most common isolated germs were staphylococcal species and regarding complications heart failure and heart embolisms predominated.
Key words: Infective endocarditis, Pediatric age, Epidemiology, Diagnosis, Complications
Introducción
La Endocarditis infecciosa (EI) es una afección microbiana de la superficie endotelial del corazón (endocardio, las válvulas o las estructuras relacionadas) generalmente sobre una lesión anterior, cuya manifestación anatomopatológica fundamental es la vegetación, constituida por una masa amorfa de plaquetas y fibrina de tamaño variable en cuya red quedan atrapados numerosos microorganismos y algunas células inflamatorias1.
La EI fue descrita por primera vez a mediados del siglo XVII1, y determinada su causa infecciosa dos siglos más tarde, con la identificación de los microorganismos en el interior de las vegetaciones2,3. En 1885, Osler efectuó una revisión clínica y patológica de más de 200 casos, y describió detalladamente la EI sobre válvula nativa, denominada entonces “Endocarditis maligna”, por tener una mortalidad de 100 %4. Este estudio resultó sumamente importante para la época.
La EI puede clasificarse de acuerdo con la evolución temporal de la enfermedad, el sitio de la infección, su causa o la presencia de un factor de riesgo predisponente5,6. Su diagnóstico se realiza por criterios clínicos, microbiológicos y ecocardiográficos, que se han modificado en el tiempo.
Según Prado et al.7, en 1981 Von Reyn y colaboradores propusieron unos criterios diagnósticos estrictos basados fundamentalmente en criterios clínicos y microbiológicos. Ellos distinguían tres tipos de diagnóstico: de certeza, probable y posible. Algunas limitaciones de estos criterios se evidenciaron con el paso de los años, en primer lugar solo en una minoría de los pacientes era posible establecer un diagnóstico de certeza; en segundo, no se tenía en cuenta la aparición de nuevos factores predisponentes como la adicción a drogas por vía parenteral, y en tercero, tampoco se establecía el valor de los hallazgos ecocardiográficos; por tanto, su aplicación, aunque importante en su momento por sentar las bases del diagnóstico y tratamiento de la EI, impedía que muchos casos pudieran ser diagnosticados debido a la reducida sensibilidad de sus criterios.
En 1994, Durack y colaboradores, según acotan Prado et al.7, propusieron una modificación que tiene como ventajas la inclusión entre los criterios diagnósticos de la adicción a drogas por vía parenteral y los hallazgos del ecocardiograma, que con el vertiginoso auge tecnológico permitiría alcanzar, una mayor sensibilidad sin haberse perdido especificidad. Quedan conformados así los Criterios de Duke, que toma su nombre por la universidad donde fueron enunciados7.
El diagnóstico de la EI es uno de los más difíciles en cardiología y no es infrecuente que se presente como una fiebre de origen desconocido, especialmente en la edad pediátrica, que obliga a diferenciarla de diversos padecimientos reumatológicos y neoplásicos, particularmente las leucemias y los linfomas. Los datos clínicos muchas veces son inespecíficos: fiebre, astenia, pérdida de peso o mal estado general y los otros síntomas, más específicos, dependen del sitio de la infección: cutánea, ocular, renal, vascular, mesentérica o cerebral8-12.
La EI es una enfermedad poco frecuente en niños; sin embargo, su incidencia se ha visto incrementada en relación al aumento de la sobrevida de pacientes con cardiopatías congénitas y al uso creciente de catéteres vasculares de larga duración, especialmente en recién nacidos pretérmino y pacientes con cáncer8-10,13.
Los agentes etiológicos más frecuentes en niños son las bacterias Gram positivas, entre ellas, el Streptococcus viridans y el Staphylococcus aureus; con menos frecuencia se aislan Enterococcus sp, Staphylococcus coagulasa negativo, Streptococcus pneumoniae y microorganismos del grupo HACEK (Haemophilus influenzae, aphrophilus, paraphrophilus; Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella sp. y Kingella kingae). Excepcionalmente se observan endocarditis causadas por Candida sp. y bacilos Gram negativos entéricos8,9,13-15.
Las tasas de incidencia informadas son aproximadamente de 0,3 a 0,5 % de los pacientes ingresados anualmente, con un caso por cada 1.280 ingresos pediátricos por año y no hay diferencias por sexo o raza11.
La experiencia acumulada en el diagnóstico, presentación clínica y evolución pronóstica de los pacientes hospitalizados con EI en un centro de referencia, como lo es el Cardiocentro Pediátrico “William Soler”, así como la carencia de investigaciones que aborden esta temática en nuestro medio, nos motivó a realizar este estudio con el objetivo de describir las características clínico-epidemiológicas de la endocarditis infecciosa pediátrica en los pacientes ingresados.
Método
Contexto y clasificación del estudio
Se realizó un estudio observacional descriptivo, retrospectivo, en los pacientes ingresados con el diagnóstico de EI en el Cardiocentro Pediátrico “William Soler” de La Habana, Cuba, desde enero de 2000 a julio de 2012.
Universo y muestra
Se incluyeron los 33 pacientes ingresados por EI, en el período de estudio, que cumplían exhaustivamente los Criterios de Duke para esta enfermedad, según los datos recogidos de las historias clínicas.
Variables estudiadas
Las variables estudiadas fueron: edad, sexo, presencia de cardiopatía congénita, factores de riesgo (antecedentes de sepsis bucal o procedimiento dentario), y el uso de vías de acceso venoso profundo. Según las características clínicas de los pacientes de definió el cuadro clínico agudo o subagudo y el origen probable de la infección. Los gérmenes responsables de la EI y las complicaciones presentadas se definieron según los resultados de los complementarios realizados.
Técnicas de recolección, procesamiento y análisis de la información
Se revisaron las historias clínicas de cada uno de los pacientes, previa autorización de la dirección del centro. Las variables obtenidas fueron almacenadas y analizadas usando el paquete estadístico SPSS versión 15.0. Se determinaron frecuencias absolutas y relativas; para la asociación de las variables cualitativas, a través de tablas de contingencia, se empleó el estadígrafo X2 de independencia con su significación asociada de p (p > 0.05 no hay asociación significativa y p < 0.05, sí la hay).
Consideraciones bioéticas
Aunque no se requiere información de pacientes o familiares la investigación cumplió con los 5 principios éticos requeridos, el respeto a las personas, la beneficencia, la no maleficencia, la justicia y la autonomía, lo que garantizó la estricta confidencialidad de los datos obtenidos.
Resultados
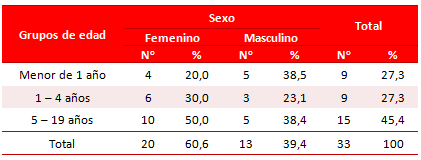
La tabla 1 muestra la distribución de los pacientes con EI según grupos de edad y sexo; el grupo más afectado fue el de 5 a 19 años con 15 pacientes (45,5 %) seguido de los menores de 1 año y el grupo entre 1 y 4 años, con nueve pacientes cada uno (27,3 %). Con relación al sexo, hubo un predominio de pacientes del sexo femenino, 20 casos (60,6 %).
Tabla 1. Distribución de pacientes según grupos de edad y sexo.
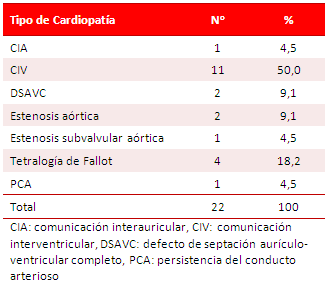
La distribución de los diferentes tipos de cardiopatías congénitas (Tabla 2) muestra que en 22 de los 33 pacientes estudiados se presentó un defecto congénito. La comunicación interventricular (CIV) en 11 (50 %), seguida por la tetralogía de Fallot en 4 casos (18,2 %). El resto, (CIA, DSAVC, estenosis valvular y subvalvular aórticas y PCA) tuvo una prevalencia baja.
Tabla 2. Distribución de los pacientes según el tipo de cardiopatía congénita.
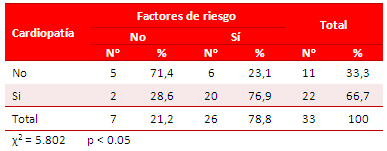
De un total de 26 pacientes (78,8 %) con algún factor de riesgo para EI, 20 eran cardiópatas (76,9%), lo que representa una asociación significativa (p < 0.05) entre la presencia de cardiopatía congénita y factores de riesgo (Tabla 3).
Tabla 3. Distribución de pacientes, según presencia de cardiopatía y factores de riesgos.
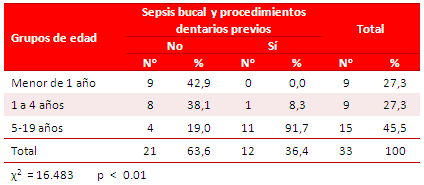
En 12 pacientes (36,4 %) se demostró el antecedente de sepsis bucal y procedimientos dentarios previos (Tabla 4), 1 de ellos (8,3 %) en el grupo de 1 a 4 años de edad y los restantes (91,7 %), de 5 a 19; grupo etario que presentó una diferencia estadística significativa (p < 0.01).
Tabla 4. Distribución de pacientes con sepsis bucal y procedimientos dentarios, según grupos de edades.
En la tabla 5 se distribuyen los pacientes con EI y antecedentes de uso de catéteres intravasculares, según grupos de edad. El grupo de pacientes menores de 1 año fue el más afectado con 7 de 9 casos, que representan el 58,3 % de los 12 donde se utilizaron dispositivos intravasculares, por lo que la diferencia estadística fue significativa (p=0.05).
Tabla 5. Distribución de pacientes con antecedentes de uso de catéter intravascular, según grupos de edades.
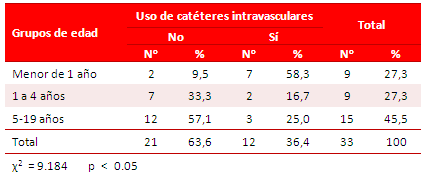
En el gráfico 1, panel superior, se muestra que el curso clínico predominante en la EI de estos pacientes fue un cuadro séptico subagudo (78,8 %), y en el inferior, que predominó el origen nosocomial de la infección (57,6 %).
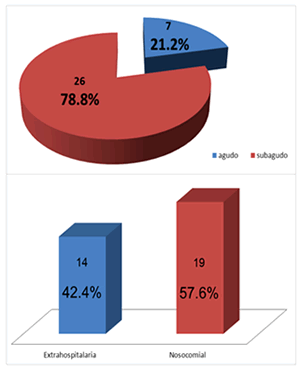
Grafico 1. Distribución de los centenarios, según variables ecocardiográficas de la función diastólica del VI.
Los hemocultivos (Gráfico 2) resultaron positivos en 25 pacientes (75,8 %), en los que, con mayor frecuencia, se aislaron especies de Staphylococcus coagulasa negativo (32 %), coagulasa positivo (24 %) y Streptococcus viridans (20 %).
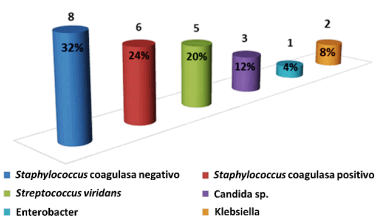
Gráfico 2. Distribución de pacientes según germen aislado en hemocultivos.
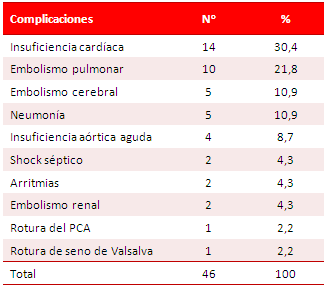
Encontramos 46 complicaciones, de lo que se deduce que hubo pacientes que presentaron más de una (Tabla 6). En 14 se diagnosticó insuficiencia cardíaca, lo que representa el 30,4 % del total de complicaciones; 10 presentaron embolismo pulmonar (21,8 %) y 5 (10,9 %), embolismo cerebral y neumonía, respectivamente. Si consideramos los fenómenos embólicos en su totalidad, pulmonares, cerebrales y renales, estos prevalecen sobre la insuficiencia cardíaca.
Tabla 6. Distribución de pacientes según complicaciones.
Discusión
La distribución de los casos según su edad asemeja la distribución bimodal encontrada por Day et al.16, en 1.588 casos, con picos de incidencia en lactantes y en mayores de 17 años. No se encuentra explicación para el comportamiento del grupo de 1 a 4 años que también tiene 9 pacientes.
Otros estudios no describen este tipo de comportamiento y muestran predominio en los lactantes17. El resto de los estudios consultados, muestran edades medias que oscilan entre 5,8 y 8,6 años9,18.
Con relación al sexo, en esta serie hubo un predominio de EI en pacientes del sexo femenino, lo que coincide con lo encontrado por Marom et al.10 en Israel y Bitar et al.12 el Líbano.
En la distribución de los diferentes tipos de cardiopatías, llama la atención que en 22 de los 33 pacientes se presentó un defecto congénito, lo que coincide con múltiples estudios que reafirman a este antecedente como el principal predisponente de EI en la edad pediátrica13,15,19. Autores como Johnson et al.20, en una revisión de 60 años en la Clínica Mayo hallaron a la CIV en el 35 % de los pacientes con EI y Niwa et al.15 informan que la CIV como cardiopatía solitaria se presentó en el 37,5 % de sus enfermos por lo que fue la más prevalente, sin embargo, en su conjunto, las cardiopatías congénitas cianóticas fueron más frecuentes. Por su parte Bittar et al.12, señalan a la tetralogía de Fallot y la estenosis pulmonar como las cardiopatías de mayor importancia.
Saxena et al.21, encontraron cardiopatías congénitas en 17 de los 19 casos estudiados y, de estos, hubo otra condicionante de riesgo en 10. En el estudio de Valente et al.22, en 9 de los 10 casos con EI de su serie, se presentó cardiopatía congénita, con prevalencia de dos factores que fueron: el uso de catéteres venosos profundos (en 7 casos) y la cirugía reciente de la cardiopatía en 5. También se estudió la prematuridad que no fue considerada en este estudio. Sadiq et al.19 informan un 45 % de malformaciones cardíacas, lo que contrasta con un 53 % de cardiopatía reumática, y el antecedente de cirugía cardíaca previa fue encontrado en 4 pacientes.
Prevalecieron igualmente las condiciones predisponentes en pacientes con malformaciones cardiovasculares en la investigación de Niwa et al.15 y para autores como Casanova23, el foco de bacteriemia se halla en dos tercios de los pacientes, de ahí que hayan sido las intervenciones dentales y la cirugía las más importantes.
El riesgo de bacteriemia tras extracciones dentales es de 60 %, tras cirugía periodontal de 88 %, y tras amigdalectomía, de 35 %11,24. Entre las múltiples causas de bacteriemias destaca para varios autores la provocada por la sepsis bucal y los procedimientos dentarios que llega a alcanzar hasta el 46 % de las potenciales bacteriemias15,25.
Se reconocen los rasgos distintivos de los factores de riesgo para la EI en los lactantes, y se plantea que en este grupo etario prevalecen la prematuridad, la inmunodepresión y el uso de catéteres venosos profundos26,27, diferenciándose por ello de los otros grupos de edad.
Para Valente et al.22 fue muy prevalente el uso de catéteres endovenosos y su relación con la bacteriemia (73 %) y aunque el objetivo primario del estudio no fue la EI, sino la bacteriemia por Staphylococcus aureus, resultó importante el por ciento de pacientes que desarrolló bacteriemia en relación al uso de catéteres; pues hubo 10 casos de EI, de los que 7 usaron catéteres, además de ser el Staphylococcus aureus el germen aislado en todos los casos.
La bibliografía consultada al respecto plantea que la EI se presenta como un estado toxinfeccioso importante, sin embargo en la mayoría de los casos se manifiesta con síntomas y signos de tipo inespecíficos, de duración prolongada que al ser valorado por otros especialistas, se llegan a considerar otros padecimientos como los autoinmunes, reumatológicos, y tumorales24,28,29.
Ishiwada et al.13 observaron una relación directa entre el microorganismo causal y el perfil clínico de la EI con diferencia en la presentación toxinfecciosa aguda típica producida por Staphylococcus coagulasa positivo de la forma subaguda dependiente del resto de los microorganismos aislados en su trabajo, y en la serie de Peña et al.30 predominó la presentación subaguda; sin embargo la principal causa de muerte fue la insuficiencia cardíaca aguda.
En la serie de Marom et al.10, no se informó un predominio sustancial de EI de adquisición nosocomial en 30 de sus 51 casos (59 %). Similar comportamiento se describe en la investigación realizada en el Stollery Children’s Hospital donde de 31 casos estudiados, 19 presentaron EI de adquisición nosocomial31. Otros autores han encontrado frecuencias de infección nosocomial mucho más bajas con apenas 10 % en sus respectivas series, de ellos la mitad asociados a dispositivos intravasculares31,32.
En esta serie además del uso de catéteres intravasculares, se presentó la cirugía cardiovascular reciente en 11 casos, por lo que estas dos variables sumadas pudiesen explicar el discreto predominio de la EI de origen nosocomial. Este resultado resulta interesante y difiere con el de la mayoría de los autores que ubican a las especies de Staphylococcus aureus (coagulasa positivo) y Streptococcus viridans como las bacterias más frecuentemente aisladas en los hemocultivos de pacientes con EI9,10,14,16-18. Otros han encontrado predominio del Staphylococcus coagulasa negativo y lo asocian a EI sobre válvula protésica o a la cirugía cardiovascular1,33,34.
El hecho de que en nuestra serie solo hayamos encontrado 1 caso con EI sobre válvula protésica se atribuye a que hubo 11 cirugías cardiovasculares reconstructivas en pacientes con malformaciones congénitas.
Es importante señalar la tendencia manifiesta al predominio de EI por Staphylococcus aureus tanto sobre válvula nativa, como protésica, que tradicionalmente se consideraba causada por Staphylococcus epidermidis (coagulasa negativo)4,35.
Las complicaciones de la EI son numerosas y muchos autores las clasifican en dos grandes grupos: intra y extracardíacas12,13. Dentro del primer grupo tenemos la insuficiencia cardíaca congestiva, la fístulas y abscesos intracardíacos, hemopericardio, taponamiento cardíaco, insuficiencia valvular y fisura o rotura del seno de Valsalva; mientras en el segundo grupo se señalan los embolismos a diferentes niveles (renal, neurológico, pulmonar, esplénico); así como los fenómenos de autoinmunidad9,14,15. En este sentido, nuestros resultados coinciden con los de otros autores15,28,36,37, quienes consideran a la insuficiencia ventricular izquierdo como la primera entre las complicaciones de la EI, debido a afectación valvular, que ocasiona trastorno hemodinámico. Ferrieri6 y Paganini18 también coinciden en que la disfunción ventricular es la complicación más frecuente, asociada a la infección por Staphylococcus aureus y constituye además causa frecuente de intervención quirúrgica6,18. Schroth et al.37, en su serie, informan 6 casos de embolismo pulmonar en 11 pacientes con EI; para Knirsch y Nadal38 los fenómenos embólicos
cerebrales y pulmonares representaron el 33 y el 28 % respectivamente; mientras que Hoyer y Silberbach39 consideran que el embolismo pulmonar se presenta en 10 % de los casos de EI en edad pediátrica, superado en frecuencia por la insuficiencia valvular y las complicaciones propias de la intervención quirúrgica. Otro grupo de autores8, con los que no concordamos, desestima al embolismo pulmonar como complicación de importancia.
Conclusiones
La EI predominó en escolares de sexo femenino, con CIV y tetralogía de Fallot como cardiopatías congénitas subyacentes. Los procedimientos dentarios y el uso de catéteres intravasculares tuvieron una asociación importante con la EI. La presentación clínica subaguda y el origen nosocomial de la infección fue predominante, así como el aislamiento de la especies de Staphylococcus en los hemocultivos. La insuficiencia cardíaca congestiva y los fenómenos cardioembólicos fueron las complicaciones de mayor relevancia.
Referencias bibliográficas
Karchmer AW. Endocarditis infecciosa. En: Zipes DP, Libby P, Bonow RO y Braunwald E, eds. Tratado de Cardiología. 7a ed. Madrid: Elsevier; 2006. p. 1633-56.
Hektoen L. The determination of the infectious nature of acute endocarditis. Arch Pathol Lab Med. 1930;9:540-56.
Malhotra A, Prendergast BD. Evaluating treatment options for patients with infective endocarditis: when is it the right time for surgery? Future Cardiol. 2012;8(6):847-61.
Horstkotte D, Follath F, Gutschik E, Lengyelk M, Oto A, Pavie A, et al. Guías de práctica clínica sobre prevención, diagnóstico y tratamiento de la endocarditis infecciosa de la Sociedad Europea de Cardiología. Versión resumida. Rev Esp Cardiol. 2004;57(10):952-62.
Valles F, Anguita, Escribano MP, Pérez F, Pousibet H, Tornos P, et al. Guías de práctica clínica de la Sociedad Española de Cardiología en endocarditis. Rev Esp Cardiol. 2000;53(10):1384-96.
Ferrieri P, Gewitz MH, Gerber MA, Newburger JW, Dajani AS, Shulman ST, et al. Unique features of infective endocarditis in childhood. Circulation. 2002;105(17):2115-26.
Prado MA, Le Corre N, Viviani T, Perret C. Endocarditis por Streptococcus pneumoniae en niños. Presentación de un caso clínico y revisión de la literatura. Rev Chil Infect. 2005;22(4):361-7.
Wei HH, Wu KG, Sy LB, Chen CJ, Tang RB. Infectious endocarditis in pediatric patients: analysis of 19 cases presenting at a medical center. J Microbiol Immunol Infect. 2010;43(5):430-7.
Lertsapcharoen P, Khongphatthanayothin A, Chotivittayatarakorn P, Thisyakorn C, Pathmanand C, Sueblinvong V. Infective endocarditis in pediatric patients: an eighteen-year experience from King Chulalongkorn Memorial Hospital. J Med Assoc Thai. 2005;88(Suppl 4):S12-6.
Marom D, Levy I, Gutwein O, Birk E, Ashkenazi S. Healthcare-associated versus community-associated infective endocarditis in children. Pediatr Infect Dis J. 2011;30(7):585-8.
Wilson W, Taubert KA, Gewitz M, Lockhart PB, Baddour LM, Levison M, et al. Prevention of infective endocarditis: guidelines from the American Heart Association: a guideline from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation. 2007;116(15):1736-54.
Bittar FF, Jawdi RA, Dbaibo GS, Yunis KA, Gharzeddine W, Obeid M. Paediatric infective endocarditis: 19-year experience at a tertiary care hospital in a developing country. Acta Paediatr. 2000;89(4):427-30.
Ishiwada N, Niwa K, Tateno S, Yoshinaga M, Terai M, Nakazawa M, et al. Causative organism influences clinical profile and outcome of infective endocarditis in pediatric patients and adults with congenital heart disease. Circ J. 2005;69(10):1266-70.
Al-Jarallah AS, Lardhi AA, Hassan AA. Endocarditis prophylaxis in children with congenital heart disease. A parent's awareness. Saudi Med J. 2004;25(2):182-5.
Niwa K, Nakazawa M, Tateno S, Yoshinaga M, Terai M. Infective endocarditis in congenital heart disease: Japanese national collaboration study. Heart 2005;91(6):795-800.
Day MD, Gauvreau K, Shulman S, Newburger JW. Characteristics of children hospitalized with infective endocarditis. Circulation. 2009;119(6):865-70.
Ystúriz N, Arispe E. Endocarditis infecciosa en el Hospital "J.M. de Los Ríos". Bol Hosp Niños J. M. de los Ríos. 2005;41(1):13-8.
Paganini H, Firpo V, Villa A, Debbag R, Berberian G, Casimir L, et al. Análisis clínico y de los factores de riesgo de mortalidad de 86 casos de endocarditis infecciosa en niños y adolescentes en Argentina (1988-2000). Enferm Infecc Microbiol Clin. 2004;22(8):455-61.
Sadiq M, Nazir M, Sheikh SA. Infective endocarditis in children – incidence, pattern, diagnosis and management in a developing country. Int J Cardiol 2001;78(2):175-82.
Johnson JA, Boyce TG, Cetta F, Steckelberg JM, Johnson JN. Infective endocarditis in the pediatric patient: a 60-year single-institution review. Mayo Clin Proc. 2012;87(7):629-35.
Saxena A, Aggarwal N, Gupta P, Juneja R, Kothari SS, Math R. Predictors of embolic events in pediatric infective endocarditis. Indian Heart J. 2009;61(3):242-5.
Valente AM, Jain R, Scheurer M, Fowler VG, Corey GR, Bengur AR, et al. Frequency of infective endocarditis among infants and children with Staphylococcus aureus bacteremia Pediatrics. 2005;115(1):e15-9.
Casanova Arzola RI. Enfermedades del endocardio. En: Casanova R, Selman-Houssein E, Savío A, Carballés JF, Palenzuela H, García C, et al; eds. Pediatría. Tomo VI. Parte XXIII. Cardiología. La Habana: Editorial Ciencias Médicas, 2011; p. 1-32.
Espiau M, Soler-Palacín P, Marimon C, Albert DC, Melendo S, Figueras M. Endocarditis infecciosa en pediatría. Protocolo de actuación. Barcelona: Hospital Universitari Vall d’Hebron, 2009. Disponible en: http://www.upiip.com/files/20110520081437_5646_b3a1110b-0d3c-43e0-be12-e6d131f6cfde.pdf
Coward K, Tucker N, Darville T. Infective endocarditis in Arkansan children from 1990 through 2002. Pediatr Infect Dis J. 2003;22(12):1048-52.
Li JS, Corey GR, Fowler VG. Infective Endocarditis. En: Topol EJ, ed. Textbook of Cardiovascular Medicine. 3ed. Philadelphia: Lippincott Williams & Wilkins, 2007; p. 402-18.
Millard DD, Shulman ST. The changing spectrum of neonatal endocarditis. Clin Perinatol. 1988;15(3):587-608.
Habib G, Hoen B, Tornos P, Thuny F, Predergast B, Vilacosta I, et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): the Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and the International Society of Chemotherapy (ISC) for Infection and Cancer. Eur Heart J. 2009;30(19):2369-413.
Gentry LO, Williams TW. Infective Endocarditis. En: Willerson JT, Cohn JN, Wellens HJJ, Holmes DR, eds. Cardiovascular Medicine. 3rd Ed. London: Springer, 2007; p. 443-62.
Peña P, López J, Huerta G, Solórzano F. Características clínico-epidemiológicas de pacientes con endocarditis infecciosa atendidos en el Hospital de Pediatría Centro Médico Nacional Siglo XXI. Enf Inf Microbiol. 2007;27(1):11-4.
Alshammary A, Hervas-Malo M, Robinson JL. Pediatric infective endocarditis: Has Staphylococcus aureus overtaken viridans group streptococci as the predominant etiological agent? Can J Infect Dis Med Microbiol. 2008;19(1):63-8.
Bernstein D. Congenital heart disease. In: Kliegman RM, Behrman RE, Jenson HB, Stanton BF, eds. Nelson’s Textbook of Pediatrics. 18th ed. Philadelphia: Elsevier, 2007; p. 1906-12.
Attie F, Zabal C, Buendía A. Cardiología pediátrica, diagnóstico y tratamiento. 1.a ed. México D.F.: Editorial Médica Panamericana; 1993. p. 95-103.
Allen HD, Driscoll DJ, Shaddy RE, Feltes TF. Moss and Adam´s Heart Disease in infants, children and adolescents. Including the fetus and young adult. 7ed. Philadelphia: Lippincott Williams and Wilkins, 2007; p. 1301-13.
Fowler VG, Miró JM, Hoen B, Cabell CH, Abrutyn E, Rubinstein E, et al. Staphylococcus aureus endocarditis: a consequence of medical progress. JAMA. 2005;293(24):3012-21.
Knirsch W, Haas NA, Uhlemann F, Dietz K, Lange PE. Clinical course and complications of infective endocarditis in patients growing up with congenital heart disease. Int J Cardiol. 2005;101(2):285-91.
Schroh AM, Cona C, Laghezza L, Domínguez P, Vergani L. Perfil clínico y oportunidad quirúrgica de la endocarditis infecciosa en pacientes pediátricos. Rev Argent Cardiol. 2002;70(4):274-81.
Knirsch W, Nadal D. Infective endocarditis in congenital heart disease. Eur J Pediatr. 2011;170(9):1111-27.
Hoyer A, Silberbach M. Infective Endocarditis. Pediatr Rev. 2005;26(11):394-400.
Recibido: 16 de julio de 2013
Aceptado: 19 de septiembre de 2013
Subir






















