CorSalud 2013 Jul-Sep;5(3):252-260
ARTÍCULO ORIGINAL
VALOR DE LA MORFINA LIOFILIZADA INTRATECAL EN LA REVASCULARIZACIÓN MIOCÁRDICA QUIRÚRGICA
MSc. Dr. Rudy Hernández Ortegaa, MSc. Dr. Osvaldo González Alfonsoa, MSc. Dr. Pedro A. Hidalgo Menéndeza, MSc. Dra Ilida M Marrero Fontb, Dr. Juan M. Rodríguez Álvareza, Dr Oliviert Nazco Hernándeza y Lic. Damicela Barreto Herreraa
______________
Departamento de Anestesiología y Reanimación. Servicio de Cirugía Cardiovascular. Cardiocentro "Ernesto Che Guevara". Villa Clara, Cuba.
Universidad de Ciencias Médicas "Dr. Serafín Ruiz de Zárate Ruiz", Clínica Estomatológica "Celia Sánchez Manduley". Santa Clara, Villa Clara, Cuba.
Correspondencia: R. Hernández Ortega. Cardiocentro "Ernesto Che Guevara". Calle Cuba N° 610 entre Barcelona y Capitán Velasco. Santa Clara, CP 50200. Villa Clara, Cuba. Correo electrónico: rudyho@cardiovc.sld.cu
Resumen
Introducción: La analgesia subaracnoidea constituye un método terapéutico útil en la cirugía cardíaca. Objetivo: Comparar el uso de la morfina subaracnoidea e intravenosa para la analgesia postoperatoria de la revasculaización miocárdica quirúrgica. Método: Se realizó un estudio comparativo, longitudinal en 40 pacientes, divididos en dos grupos. El de analgesia subaracnoidea recibió morfina liofilizada 15 mcg/kg, y el grupo de morfina intravenosa, 0,3 mg/kg previo y posterior a la cirugía. Resultados: Predominó el sexo femenino, las edades y los pesos promedio de ambos grupos fueron similares (p > 0.05). El 90 % de los enfermos del grupo de morfina subaracnoidea tuvo una analgesia excelente a las 8 horas de la intervención, y se mantuvo entre buena y excelente a las 12 y 24 horas posteriores, respectivamente; mientras que solo el 50 % de los pacientes de morfina intravenosa refirió una analgesia buena a las 8 horas de operados; y a las 24 horas, todos se quejaron de una analgesia insuficiente o mala (p < 0.05). El tiempo total promedio de analgesia postoperatoria obtenida en el grupo de morfina intratecal fue de 24,41 horas y en el de morfina intravenosa, de 8,76 horas (p < 0.01). Los principales efectos adversos fueron el prurito para ambos grupos, y la hipotensión y la bradicardia para el grupo con morfina intravenosa, aunque las diferencias no fueron significativas. Conclusiones: La morfina subaracnoidea demostró su utilidad como agente analgésico en la revascularización miocárdica quirúrgica, con mejor y más prolongada analgesia que los enfermos tratados con morfina intravenosa.
Palabras clave: Clorhidrato de morfina, Morfina liofilizada, Analgesia subaracnoidea, Revascularización miocárdica quirúrgica, Analgesia postoperatoria
Value of intrathecal lyophilized morphine in coronary artery bypass surgery
Abstract
Introduction: Subarachnoid analgesia is a useful therapeutic method in cardiac surgery. Objective: To compare the use of subarachnoid and intravenous morphine for post-operative analgesia in coronary artery bypass surgery. Method: A comparative longitudinal study was conducted in 40 patients, divided into two groups. The subarachnoid analgesia group received 15 mcg/kg of lyophilized morphine, and the intravenous morphine group received 0.3 mg/kg before and after surgery. Results: Female patients predominated. The average age and weights of both groups were similar (p > 0.05). In the subarachnoid morphine group, 90% of patients had excellent analgesia at 8 hours after surgery, and it ranged between excellent and good at 12 and 24 hours, respectively. On the other hand, only 50% of patients with intravenous morphine expressed they had a good analgesia at 8 hours after the operation; and at 24 hours they all complained of inadequate or poor analgesia (p < 0.05). The average total time of postoperative analgesia in the intrathecal morphine group was 24.41 hours, while in the intravenous morphine group it was 8.76 hours (p < 0.01). The main side effects were itching, for both groups, and hypotension and bradycardia for the intravenous morphine group, although differences were not significant. Conclusions: Subarachnoid morphine proved to be useful as an analgesic in coronary artery bypass surgery, with better and more prolonged analgesia than in those patients who were treated with intravenous morphine.
Key words: Morphine hydrochloride, Lyophilized morphine, Subarachnoid analgesia, Coronary artery bypass surgery, Postoperative analgesia
Introducción
El dolor postoperatorio tiene una gran incidencia en la cirugía cardíaca, por lo que ocupa un lugar importante de nuestra atención1. El tratamiento adecuado es esencial para garantizar la calidad asistencial del paciente operado. El uso del opio para el alivio del dolor es proverbial, se describe en diferentes tratados desde la antigüedad, en los últimos siglos se desarrollaron diferentes compuestos derivados, semisintéticos y sintéticos, conocidos de forma genérica como opioides u opiáceos, y su prototipo es la morfina1,2. Los opiodes, al depositarse localmente en la cercanía de la médula espinal, se unen a receptores pre y postsinápticos, e impiden que se liberen nuevos transmisores a este nivel, de este modo bloquean la transmisión de la información nociceptiva a nivel del asta dorsal de la médula espinal2, por lo que ofrecen una analgesia de calidad por tiempos prolongados3-6.
La revascularización miocárdica quirúrgica (RMQ) sin circulación extracorpórea (CEC) o con CEC parcial, y la utilización de agentes anestésicos de recuperación rápida (isoflorano o sevofluorano, propofol, remifentanil, o menores dosis de los opioides "clásicos", como el fentanil y surfentanil), ha logrado una recuperación más rápida de los enfermos, con tiempos cortos de ventilación mecánica postoperatoria (< 6 horas) y menor estadía en la unidad de cuidados intensivos posquirúrgicos (UCIQ), lo que ha traído consigo una mayor incidencia de dolor postoperatorio4,5.
Numerosas estrategias se han ensayado para combatirlo, desde el uso de antiinflamatorios no esteroideos, hasta la inyección parenteral de tramadol, meperidina o morfina. No obstante, estos medicamentos mantienen su efecto farmacológico por períodos cortos, generalmente 4-6 horas, y su efecto acumulativo y el escaso margen entre las dosis terapéuticas y tóxicas, reducen su eficacia4-6. La administración intratecal (IT) de morfina para el tratamiento del dolor postoperatorio de la cirugía cardíaca puede ser una alternativa a la administración de opioides por vía intravenosa (IV).
El objetivo de esta investigación ha sido comparar el efecto de la morfina administrada por vía subaracnoidea o IV, para la analgesia postoperatoria en la RMQ.
Método
Se realizó un estudio comparativo, longitudinal prospectivo, entre dos grupos de pacientes anunciados para cirugía de RMQ en el Cardiocentro "Ernesto Che Guevara" de Santa Clara, Cuba, en el período de enero a diciembre de 2012. Se seleccionaron personas adultas menores de 70 años de edad, de forma aleatoria (según Torres Delgado et al.9), clasificados en clase funcional III de la Sociedad Americana de Anestesiología y II-III de la Asociación del Corazón de Nueva York (NYHA, por sus siglas en inglés)4, con buena función ventricular previa (fracción de eyección mayor de 50 %), sin alteraciones valvulares o de la motilidad regional del ventrículo izquierdo, medicados con atenolol y nitroderivados en el preoperatorio, y que consintieron participar en el estudio.
Se excluyeron aquellos enfermos con función ventricular reducida, infarto miocárdico en los últimos 6 meses, hipersensibilidad conocida a los fármacos a emplear en el estudio, ventilación mecánica y globo de contrapulsación intraórtica o medicamentos de apoyo inotrópico previo a la cirugía; además, los pacientes que constituyeran urgencia o emergencias quirúrgicas, o que presentaran contraindicaciones absolutas o relativas para la técnica de administración IT del fármaco (punción del espacio subaracnoideo). También se excluyeron los enfermos que presentaron una enfermedad pulmonar, endocrina, metabólica o neurológica grave, y los que no completaron enteramente el período de estudio por complicaciones surgidas durante el postoperatorio (por ejemplo neumotórax, sangrado importante, atelectasia pulmonar grave), y por último, los pacientes con menos de 150.000 plaquetas/mm3, los que recibieron heparina en el preoperatorio u otros medicamentos con efecto sobre la coagulación, la antiagregación plaquetaria o ambas, y los que tenían historia anormal de sangrado.
La muestra quedó integrada por 40 pacientes, divididos a su vez en dos grupos aleatorios, cada uno con 20 participantes. En el grupo control se asoció a la anestesia general, clorhidrato de morfina IV (MIV) 0,3 mg/kg antes y después de la intervención quirúrgica; y en el grupo estudio, un bloqueo espinal subaranoideo o IT lumbar (L2-L3 ó L3-L4), a razón de 15 mcg/kg de morfina liofilizada IT (MIT).
Técnica y procedimientos
Una vez recibido el paciente en la unidad quirúrgica se premedicó con 2 mg de midazolam intravenoso, se llevó al quirófano donde se registraron los signos vitales y se procedió a realizar el abordaje espinal subaracnoideo en los espacios intervertebrales mencionados para el grupo, al cual se le administró morfina liofilizada (MIT). Para la punción dural se utilizó la posición decúbito lateral con el empleo de un trocar 25G punta de lápiz. Una vez obtenido un líquido cefalorraquídeo de aspecto claro, transparente y normotenso, se depositó 15 mcg/kg de morfina liofilizada disuelta en cloruro de sodio al 0,9 % hasta completar un volumen de 6 ml. Posteriormente, se acostó al paciente en decúbito supino y se le administró un suplemento de oxígeno por máscara; se canalizó la arteria radial izquierda para la medición cruenta de la tensión arterial, y se monitorizó la frecuencia cardíaca, la saturación pulsátil de oxígeno de la hemoglobina y la electrocardiografía continua (derivación DII).
Después de la inducción anestésica con lidocaína 2 mg/kg, tiopental 3 mg/kg, fentanil 10 mcg/kg, y vecuronio 0,2 mg/kg por vía IV, se monitorizaron la presión venosa central, el ritmo diurético, la capnografía y la temperatura central. Se colocó tubo endotraqueal y una sonda nasogástrica. La ventilación mecánica se efectuó con el volumen corriente calculado a 7 ml/kg, frecuencia respiratoria de 12 a 16 por minuto y FiO2 de 50 %, en modalidad controlada, y se reajustó de forma tal que la PaCO2 estuviera entre 35 y 45 mmHg.
El mantenimiento anestésico se realizó con isofluorano 0,8-1,0 % y dosis suplementarias de fentanil a 5 mcg/kg intravenoso, según lo demandó la estimulación quirúrgica. En el caso del grupo al cual se le administró morfina IV, una vez concluida la inducción anestésica, se procedió a administrar clorhidrato de morfina a 0,3 mg/kg de peso, previo y después del injerto aorto-coronario. La hidratación transoperatoria se mantuvo a 10 ml/kg/hora con cristaloides, más los líquidos de reemplazo, según las pérdidas extraordinarias y las necesidades hemodinámicas individuales. A todos los pacientes se les aplicó un programa de ahorro de sangre, mediante hemodilución normovolémica intencionada con donación de sangre autóloga (≈ 500 ml por paciente). El reemplazo de la sangría se hizo con coloides (gelofusín o hemohes). La sangre autóloga se repuso antes del traslado del enfermo a la UCIQ. La hemodinámica de los pacientes fue apoyada con norepinefrina, dobutamina y nitroglicerina, según las necesidades individuales de cada enfermo, y se mantuvo una vigilancia estricta de la tensión arterial, las frecuencias cardíaca y respiratoria, la saturación arterial de oxígeno y del ritmo electrocardiográfico.
Culminada la intervención quirúrgica se le administra al grupo MIV la dosis de clorhidrato de morfina previamente calculada a 0,3 mg/kg y luego, todos los pacientes fueron trasladados a la UCIQ donde se continuó la monitorización de sus parámetros vitales. La ventilación mecánica y su desconexión, se efectuó según los protocolos del centro (habitualmente antes de las 6 horas de su llegada a UCIQ), y se mantuvo un apoyo hemodinámico según las necesidades del enfermo.
La intensidad y duración del dolor se evaluaron a las 8, 12 y 24 horas de la llegada a UCIQ, para ello se utilizó la escala análoga visual (EAV) de 0 a 10, donde 0 representa ningún dolor; de 1-3, dolor leve; de 4-6, dolor moderado; de 7-9, dolor severo y 10, dolor insoportable. De esta misma forma se consideró que la calidad de la analgesia fue buena cuando el dolor fue leve (1 a 3); regular cuando el dolor fue moderado (4-6) y mala cuando el dolor fue intenso (≥ 7). Cuando no existió dolor se catalogó de excelente (EAV = 0). Con los resultados que se obtuvieron de la aplicación de la EAV se confeccionó una tabla que muestra la calidad de la analgesia postoperatoria de los dos grupos a través del tiempo. Se determinó el tiempo de analgesia postoperatoria como el tiempo transcurrido entre la inyección IT o IV del fármaco y la primera dosis de analgésico necesitada por el paciente. Se recogió la aparición de efectos colaterales referidos por la persona o constatados clínicamente por el anestesiólogo, a partir de la administración de los fármacos en cada grupo, tanto en el transoperatorio como en el postoperatorio, y se descartaron aquellos efectos atribuibles a otras causas identificables. Todos los datos se recogieron en una encuesta individual.
El tiempo de extubación fue calculado desde que el paciente ingresó en la UCIQ. Se midió la frecuencia respiratoria y se realizó gasometría arterial a su ingreso, 1 hora más tarde, en la extubación, y luego cada 6 horas. La sedación residual fue valorada por la escala de Ramsay (según refieren Congedo et al.10). Se registró el consumo de morfina IV adicional en ambos grupos, en 24 horas después de la extubación. También se registró la presencia de prurito, náusea, vómito y otras complicaciones postoperatorias (por ejemplo cefalea pospunción dural o presencia de hematoma epidural).
Resultados
En la tabla 1 se muestra la caracterización de los pacientes incluidos en el estudio. La edad (grupo MIT 67 ± 9,69 y grupo MIV 68 ± 9,71 años) y el peso corporal (MIT 65 ± 7,0 y MIV 63 ± 8,5 kg) fueron similares (p > 0.05). En ambos grupos predominó el sexo femenino y a la mayoría de los pacientes se les realizaron 2 o más puentes aorto-coronarios. El procedimiento se efectuó con el corazón latiendo, con CEC parcial o sin ella, de forma semejante en ambos grupos estudiados. No se encontraron diferencias estadísticas entre ambos grupos (p > 0.05), lo que garantizó su comparabilidad.
Tabla 1. Caracterización de los pacientes según el grupo (estudio o control).
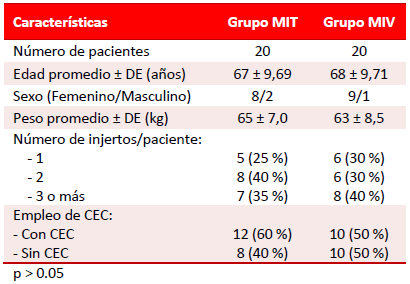
El grado de analgesia postoperatoria se resume en la tabla 2. Según la EAV, el 90 % de los enfermos del grupo MIT tenían analgesia excelente a las 8 horas de la intervención, y se mantuvo entre buena y excelente aún a las 12 horas de operados; a las 24 horas, el 80 % mantenía un buen nivel de analgesia; en estos enfermos no se encontraron casos con altas puntuaciones de la EAV en ninguna de las mediciones realizadas. Contrariamente, el 50 % de los pacientes del grupo MIV referían una analgesia buena a las 8 horas de operados, que disminuyó al 30 % de los enfermos a las 12 horas. La totalidad de los pacientes se aquejaban de una analgesia insuficiente o mala a las 24 horas de operados. Es significativo, que en este grupo, no se encontró ningún enfermo con analgesia "excelente" en ninguna de las mediciones. Las diferencias encontradas entre ambos grupos fueron estadísticamente significativas (p < 0.05).
Tabla 2. Comparación del grado de analgesia obtenido en ambos grupos según la EAV.
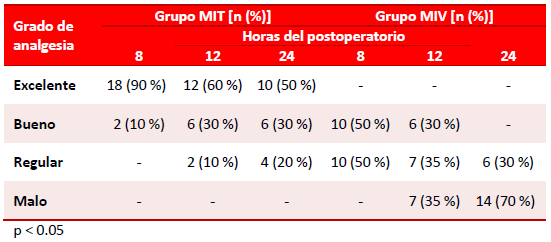
El tiempo total promedio de analgesia postoperatoria, en los dos grupos, se mantuvo en el 50 % o más de los pacientes, con una EAV con puntuación menor a 4 (Tabla 3); pero se encontraron diferencias altamente significativas entre ambos grupos (p < 0.01). Así, el tiempo promedio de analgesia del grupo MIT fue de 24,41 horas, mientras que el del grupo MIV, fue apenas de 8,76 horas, 3 veces menos que en los casos del grupo estudio.
Tabla 3. Tiempos totales promedio de analgesia y extubación postoperatorios.
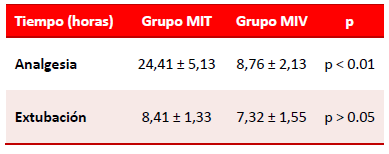
Los tiempos de extubación fueron similares en los dos grupos, sin encontrar diferencias estadísticamente significativas (MIT 8,41 ± 1,33 vs. MIV 7,32 ± 1,55 horas; p > 0.05), y el nivel de sedación en la escala de Ramsay fue similar en los dos grupos durante las 24 horas posteriores a la extubación, de ahí que se encontrara la mayor parte de los pacientes en el grado 2 (consciente y colaborador).
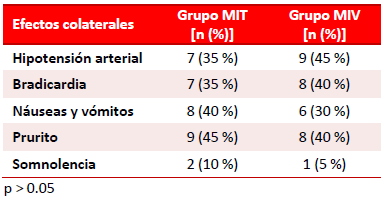
Los efectos colaterales más frecuentes, una vez efectuada la administración de los medicamentos antes mencionados, fueron la bradicardia y la hipotensión arterial (Tabla 4), que aunque no mostraron diferencias significativas, predominaron en el grupo MIV (45 % de hipotensión y 40 % de bradicardia). No se encontraron otras reacciones de interés en el transoperatorio. Ya en el postoperatorio, la aparición de prurito en la recuperación anestésica del enfermo fue similar en ambos grupos, con una incidencia esperada entre 40 – 45 %, algo más elevada en el grupo MIT. Otras reacciones colaterales atribuibles al uso de la morfina por cualquier vía incluyen el estado nauseoso (8 enfermo en el grupo MIT vs. 6 en el grupo MIV) y la somnolencia (2 en el MIT vs. 1 en el MIV). No existieron diferencias estadísticas entre ambos grupos en estos parámetros (p > 0.05), ni se apreciaron casos de insuficiencia o depresión respiratoria u otras manifestaciones alérgicas. Así mismo, no se encontró ningún caso con complicaciones propias de la punción lumbar (infección, meningitis, hematoma epidural, entre otras).
Tabla 4. Complicaciones y efectos colaterales encontrados, atribuibles a la técnica anestésica.
Discusión
El empleo de técnicas de bloqueo espinal subaracnoidea asociado a la anestesia general, trae ventajas al enfermo, no solo porque interrumpe el arco reflejo medular, sino también por la posibilidad de ofrecer analgesia postoperatoria. En la cirugía torácica, generalmente se prefiere la localización dorsal de un catéter epidural (T4 a T10), de igual forma el bloqueo subaracnoideo lumbar ha demostrado ser muy eficaz. La utilización de morfina liofilizada en la revascularización miocárdica aumenta los beneficios de la anestesia en la toracotomía, al permitir una técnica de anestesia general "ligera" con unos efectos de depresión respiratoria residual disminuidos11-15.
La aplicación de morfina IT como técnica analgésica en pacientes operados de cirugía cardíaca se inició por los trabajos de Matthews and Abrams publicados en 19803. En un estudio multicéntrico se observó que aproximadamente el 8 % de los anestesiólogos realizan rutinariamente técnicas de anestesia espinal en pacientes operados de cirugía cardíaca. La administración de morfina IT para el tratamiento del dolor postoperatorio en cirugía cardíaca es una alternativa a la administración de morfina IV; sin embargo, su administración por vía IT puede implicar la aparición de importantes efectos secundarios: meningitis, cefalea pospunción lumbar, hematoma epidural, depresión respiratoria13,14. Para poder considerar la administración de morfina IT como una técnica analgésica rutinaria debería de aportar más ventajas sobre estos posibles problemas. El presente estudio demuestra que la administración de morfina IT, como régimen analgésico después de la cirugía cardíaca, en comparación con el régimen analgésico convencional intravenoso a demanda, ofrece algunas ventajas sobre todo desde el punto de vista de alivio del dolor; pues los enfermos que recibieron morfina IT necesitaron menos consumo intravenoso de medicamentos analgésicos, por ello el perfil de efectos adversos y la recuperación postoperatoria de los pacientes son semejantes en ambos grupos.
Hasta la actualidad la dosis analgésica óptima de morfina IT para el postoperatorio de cirugía cardíaca sigue sin estar definida16-18. La administración de dosis elevadas de morfina IT (4 mg), inmediatamente antes de la inducción de la anestesia, logra un excelente control del dolor postoperatorio, pero asociado a retraso en el despertar, sedación postoperatoria y retraso en la extubación. La administración de dosis menores de morfina IT (250 µg a 2 mg), suministran analgesia residual en el período postoperatorio y descienden los requerimientos analgésicos, sin retrasar la extubación y con mínimos efectos secundarios19. Actualmente, se considera que la mayoría de los pacientes operados de cirugía cardíaca pueden extubarse entre 2 - 4 horas después de la cirugía, independientemente a que se utilicen técnicas epidurales, intradurales o analgesia controlada por el paciente en bolos IV18-20.
En este estudio, los tiempos de extubación prolongados pudieran atribuirse a que la recuperación postoperatoria se realizó lentamente, para permitir un tiempo suficiente para el recalentamiento del paciente, la estabilidad hemodinámica con necesidades mínimas de apoyos inotrópicos y vasoactivos, el mínimo sangrado a través de los tubos de drenaje torácicos; además no se debe dejar de mencionar que en nuestro medio aún utilizamos como analgésico el fentanilo, que tiene una vida media de eliminación demorada, a diferencia de otros como el remifentanilo, lo cual pudiera justificar de cierta manera, un retraso importante en la extubación.
Por otra parte, se han comunicado tiempos de extubación endotraqueal prolongado en los pacientes que reciben morfina IT (10 µg/kg) junto con fentanilo (20 µg/kg); sin embargo, otros autores observan que con la utilización de pequeñas dosis de fentanilo IV (2-4 µg/kg), seguido de morfina IT (10 µg/kg), se puede conseguir la extubación endotraqueal en el mismo quirófano sin incrementar la incidencia de complicaciones respiratorias17,18.
De los cuatro efectos adversos clásicos descritos en las primeras 24 horas después de la administración de morfina IT: prurito, náuseas, vómitos y depresión respiratoria, su incidencia en el grupo MIT fue muy baja, similar al grupo MIV y a los hallazgos de otros estudios15,18,19. En esta investigación no se detectó ningún caso de depresión respiratoria, evaluada por el incremento de la PaCO2 o el descenso de la frecuencia respiratoria después de la extubación.
La complicación más grave de la administración de morfina IT, especialmente en los enfermos con anticoagulación sistémica, es el hematoma espinal epidural21,22, que no fue observado ni en este estudio ni en otros de los publicados y revisados, en los que se empleó heparina para la anticoagulación sistémica después de un procedimiento neuroaxial en pacientes operados de cirugía cardíaca.
Con las dosis de morfina IT empleadas en esta investigación (15 µg/kg) se obtuvo una adecuada analgesia postoperatoria, sin comprometer la extubación y con menor consumo de morfina IV; ya que únicamente el 30 % de los pacientes precisaron bolos adicionales IV del fármaco.
Los pacientes tratados con morfina IT, mostraron menores niveles de puntuación en la EAV y, subjetivamente, referían sentirse mejor en el postoperatorio. Esto coincide con diferentes informes de la literatura de referencia21-25. Ahora bien, el bloqueo subaracnoideo no está exento de riesgos. De todos los efectos colaterales los que más se presentan son la hipotensión arterial, que aparece básicamente por liberación de histamina y vasodilatación manifiesta con el uso de opiodes, sobre todo cuando este se utiliza por vía endovenosa, lo que puede afectar los valores mínimos de autorregulación cardíaca y cerebral, y provocar daño en la perfusión de estos órganos. No obstante, con una oxigenación adecuada, si se rellena de forma óptima el espacio vascular con cristaloides y coloides, y se emplean vasopresores (efedrina, fenilefrina o norepinefrina, dopamina), de forma temprana y eficaz, se puede contrarrestar este inconveniente, y minimizar los riesgos26,27. Mucho más frecuente con el empleo de opioides parenterales, y en este caso neuroaxiales, es la bradicardia que se debe al efecto vagolítico de los narcóticos, sumado al uso concomitante de agentes bradicardizantes (betabloqueadores y anticálcicos)28, pero se resuelve fácilmente con el uso de medicamentos inotrópicos.
Son bien conocidos los efectos emetizantes de los opioides administrados por cualquier vía, incluso los de administración espinal, debido a la dispersión cefálica del agente en el líquido cefalorraquídeo hacia el centro del vómito, en la zona quimiorreceptora bulbar. No obstante, las náuseas y los vómitos no causados por narcóticos, son complicaciones comunes de la anestesia y la cirugía29. Especial atención provoca, sin embargo, la aparición de prurito, con mayor incidencia en el grupo MIT; se plantea que su ocurrencia pudiera ser un reflejo de una liberación aguda o excesiva de histamina, o por la diseminación rostral del narcótico, con efecto directo sobre los receptores Mu, lo cual resulta en alteraciones de la sensación cutánea y la percepción del dolor, especialmente a nivel de las astas dorsales del cordón espinal1,2. Otras teorías que se han planteado incluyen la acción del bisulfito sódico contenido como aditivo en los viales de morfina30 o por el efecto del fármaco sobre el núcleo del trigémino31.
Varios autores plantean que el prurito es el efecto adverso más frecuente en sus investigaciones, pues ha aparecido hasta en el 50 % de los casos32-35. Algunos lo han encontrado a partir de las 18 horas. Generalmente afecta más a mujeres obstétricas y se localiza habitualmente en la cara y en el tórax36-39.
La depresión respiratoria tardía, es muy poco vista con la morfina espinal a bajas dosis (menos de 0,2 mg) y la incidencia de este efecto adverso es de 1,9-2,3 % en los EEUU, y 0,09 % en Suecia40-42. En nuestra serie, no se presentó ningún caso debido a que los pacientes se mantienen intubados hasta que cumplan con los criterios clínicos y gasométricos para la extubación43.
Conclusiones
Los pacientes a los cuales se les administró morfina liofilizada espinal subaracnoidea tuvieron mejor y más prolongada analgesia que los enfermos tratados solo con clorhidrato de morfina IV. El tiempo promedio de duración de la analgesia fue 3 veces mayor con la adición de morfina al bloqueo IT. La aparición de prurito fue el efecto adverso postoperatorio de mayor relevancia en la mayoría de los pacientes, con mayor incidencia en el grupo MIT y no se presentaron complicaciones graves en ninguno de los grupos de estudio.
Referencias bibliográficas
Bromage PR. The physiology and pharmacology of epidural blockade. Clin Anesth. 1969;2:45-61.
Catterall W, Mackie K. Anestésicos locales. En: Goodman and Gilman. Las bases farmacológicas de la terapéutica.12th ed. México: McGraw-Hill Interamericana; 2010. p. 353-71.
Sandby-Thomas M, Sullivan G, Hall JE. A national survey into the perioperative anaesthetic management of patients presenting for surgical correction of a fractured neck of femur. Anaesthesia. 2008;63(3):250-8.
Stegmann GF. Cardiovascular effects of epidural morphine or ropivacaine in isoflurane-anaesthetised pigs during surgical devascularisation of the liver. J S Afr Vet Assoc. 2010;81(3):143-7.
Sullivan JT, Grobman WA, Bauchat JR, Scavone BM, Grouper S, McCarthy RJ, et al. A randomized controlled trial of the effect of combined spinal-epidural analgesia on the success of external cephalic version for breech presentation. Int J Obstet Anesth. 2009;18(4):328-34.
Visser WA, Lee RA, Gielen MJ. Factors affecting the distribution of neural blockade by local anesthetics in epidural anesthesia and a comparison of lumbar versus thoracic epidural anesthesia. Anesth Analg. 2008;107(2):708-21.
Almeida TF, Fantoni DT, Mastrocinque S, Tatarunas AC, Imagawa VH. Epidural anesthesia with bupivacaine, bupivacaine and fentanyl, or bupivacaine and sufentanil during intravenous administration of propofol for ovariohysterectomy in dogs. J Am Vet Med Assoc. 2007;230(1):45-51.
Huang YS, Lin LC, Huh BK, Sheen MJ, Yeh CC, Wong CS, et al. Epidural clonidine for postoperative pain after total knee arthroplasty: a dose-response study. Anesth Analg. 2007;104(5):1230-5.
Torres Delgado LA, Rubén Quesada M, Bayarre Vea H, Garriga Sarria EP, Pría Borras MC, Gran Álvarez M, et al. Bioestadística. En: Informática Médica. Vol. 2. La Habana. ECIMED; 2004. p. 630.
Congedo E, Sgreccia M, De Cosmo G. New drugs for epidural analgesia. Curr Drug Targets. 2009;10(8):696-706.
Lenkutis T, Benetis R, Sirvinskas E, Raliene L, Judickaite L. Effects of epidural anesthesia on intrathoracic blood volume and extravascular lung water during on-pump cardiac surgery. Perfusion. 2009;24(4):243-8.
Mehta Y, Arora D, Sharma KK, Mishra Y, Wasir H, Trehan N. Comparison of continuous thoracic epidural and paravertebral block for postoperative analgesia after robotic-assisted coronary artery bypass surgery. Ann Card Anaesth. 2008;11(2):91-6.
Mhuircheartaigh RJ, Moore RA, McQuay HJ. Analysis of individual patient data from clinical trials: epidural morphine for postoperative pain. Br J Anaesth. 2009;103(6):874-81.
Mulroy MF. Epidural hydromorphone: a step closer to the view from the top. Reg Anesth Pain Med. 2010;35(4):333-4.
Leo S, Ocampo CE, Lim Y, Sia AT. A randomized comparison of automated intermittent mandatory boluses with a basal infusion in combination with patient-controlled epidural analgesia for labor and delivery. Int J Obstet Anesth. 2010;19(4):357-64.
Bonnet MP, Mignon A, Mazoit JX, Ozier Y, Marret E. Analgesic efficacy and adverse effects of epidural morphine compared to parenteral opioids after elective caesarean section: a systematic review. Eur J Pain. 2010;14(9):894 e1-9.
Skupski DW, Abramovitz S, Samuels J, Pressimone V, Kjaer K. Adverse effects of combined spinal-epidural versus traditional epidural analgesia during labor. Int J Gynaecol Obstet. 2009;106(3):242-5.
Chaney MA. Thoracic epidural anaesthesia in cardiac surgery – the current standing. Ann Card Anaesth. 2009;12(1):1-3.
Hansdottir V, Philip J, Olsen MF, Eduard C, Houltz E, Ricksten SE. Thoracic epidural versus intravenous patient-controlled analgesia after cardiac surgery: a randomized controlled trial on length of hospital stay and patient-perceived quality of recovery. Anesthesiology. 2006;104(1):142-51.
Landoni G. Epidural anesthesia and analgesia in cardiac surgery. Minerva Anestesiol. 2008;74(11):617-8.
Bignami E, Landoni G, Biondi-Zoccai GG, Boroli F, Messina M, Dedola E, et al. Epidural analgesia improves outcome in cardiac surgery: a meta-analysis of randomized controlled trials. J Cardiothorac Vasc Anesth. 2010;24(4):586-97.
Royse CF. High thoracic epidural analgesia for cardiac surgery: time to move from morbidity to quality of recovery indicators. Ann Card Anaesth. 2009;12(2):168-9.
Royse CF. High thoracic epidural anaesthesia for cardiac surgery. Curr Opin Anaesthesiol. 2009;22(1):84-7.
Sendasgupta C, Makhija N, Kiran U, Choudhary SK, Lakshmy R, Das SN. Caudal epidural sufentanil and bupivacaine decreases stress response in paediatric cardiac surgery. Ann Card Anaesth. 2009;12(1):27-33.
Tenenbein PK, Debrouwere R, Maguire D, Duke PC, Muirhead B, Enns J, et al. Thoracic epidural analgesia improves pulmonary function in patients undergoing cardiac surgery. Can J Anaesth. 2008;55(6):344-50.
Royse C, Remedios C, Royse A. High thoracic epidural analgesia reduces the risk of long-term depression in patients undergoing coronary artery bypass surgery. Ann Thorac Cardiovasc Surg. 2007; 13(1):32-5.
Wijeysundera DN, Beattie WS, Austin PC, Hux JE, Laupacis A. Epidural anaesthesia and survival after intermediate-to-high risk non-cardiac surgery: a population-based cohort study. Lancet. 2008;372(9638):562-9.
Bakhtiary F, Therapidis P, Dzemali O, Ak K, Ackermann H, Meininger D, et al. Impact of high thoracic epidural anesthesia on incidence of perioperative atrial fibrillation in off-pump coronary bypass grafting: a prospective randomized study. J Thorac Cardiovasc Surg. 2007;134(2):460-4.
Bromage PR, Burfoot MF. Quality of epidural blockade. II. Influence of physico-chemical factors; hyaluronidase and potassium. Br J Anaesth. 1966;38(11):857-65.
Dayioğlu H, Baykara ZN, Salbes A, Solak M, Toker K. Effects of adding magnesium to bupicaine and fentanyl for spinal anesthesia in knee arthroscopy. J Anesth. 2009;23(1):19-25.
Wang X, Zhang X, Cheng Y, Li C, Zhang W, Liu L, et al. Alpha-lipoic acid prevents bupivacaine-induced neuron injury in vitro through a PI3K/Akt-dependent mechanism. Neurotoxicology. 2010;31(1):101-12.
Singh R, Kumar N, Singh P. Randomized controlled trial comparing morphine or clonidine with bupivacaine for caudal analgesia in children undergoing upper abdominal surgery. Br J Anaesth. 2011;106(1):96-100.
Choi PT, Beattie WS, Bryson GL, Paul JE, Yang H. Effects of neuraxial blockade may be difficult to study using large randomized controlled trials: the PeriOperative Epidural Trial (POET) Pilot Study. PLoS One. 2009;4(2):e4644.
Davies RG, Myles PS, Graham JM. A comparison of the analgesic efficacy and side-effects of paravertebral vs epidural blockade for thoracotomy – a systematic review and meta-analysis of randomized trials. Br J Anaesth. 2006;96(4):418-26.
Horstman DJ, Riley ET, Carvalho B. A randomized trial of maximum cephalad sensory blockade with single-shot spinal compared with combined spinal-epidural techniques for cesarean delivery. Anesth Analg. 2009;108(1):240-5.
Macarthur A, Imarengiaye C, Tureanu L, Downey K. A randomized, double-blind, placebo-controlled trial of epidural morphine analgesia after vaginal delivery. Anesth Analg. 2010;110(1):159-64.
Macfarlane AJ, Pryn A, Litchfield KN, Bryden F, Young S, Weir C, et al. Randomised controlled trial of combined spinal epidural vs. spinal anaesthesia for elective caesarean section: vasopressor requirements and cardiovascular changes. Eur J Anaesthesiol. 2009;26(1):47-51.
Wang F, Shen X, Guo X, Peng Y, Gu X. Epidural analgesia in the latent phase of labor and the risk of cesarean delivery: a five-year randomized con-trolled trial. Anesthesiology. 2009;111(4):871-80.
Wang LZ, Chang XY, Liu X, Hu XX, Tang BL. Comparison of bupivacaine, ropivacaine and levobupivacaine with sufentanil for patient-controlled epidural analgesia during labor: a randomized clinical trial. Chin Med J (Engl). 2010;123(2):178-83.
Clemente A, Carli F. The physiological effects of thoracic epidural anesthesia and analgesia on the cardiovascular, respiratory and gastrointestinal systems. Minerva Anestesiol. 2008;74(10):549-63.
Huang CH. Effect of cervical epidural blockade with 2% lidocaine plus epinephrine on respiratory function. Acta Anaesthesiol Taiwan. 2007;45(4): 217-22.
Nolte JE, Dette F, Cassel W, Riese C, Augsten M, Koehler U. [Long-term opioid therapy and respiratory insufficiency during sleep]. Pneumologie. 2010;64(4):241-5.
Ulke ZS, Senturk M. Non-analgesic effects of thoracic epidural anesthesia. Agri. 2007;19(2):6-12.
Recibido: 27 de octubre de 2012
Modificado: 10 de diciembre de 2012
Aceptado: 14 de enero 2013
Subir






















