CorSalud 2013 Abr-Jun;5(2):189-197
ARTÍCULO DE REVISIÓN
DISFUNCIÓN VENTRICULAR IZQUIERDA EN PACIENTES CON INFECCIÓN POR VIRUS DE INMUNODEFICIENCIA HUMANA
Dr. Alexander Valdés Martína y Dra. Angélica M. Reyes Pérezb
______________
Instituto de Cardiología y Cirugía Cardiovascular. La Habana. Cuba.
Instituto de Medicina Tropical "Pedro Kourí". La Habana. Cuba.
Correspondencia:A Valdés Martín. Instituto de Cardiología y Cirugía Cardiovascular. Calle 17 N° 702. El Vedado, Plaza CP 10400. La Habana, Cuba. Correo electrónico: avaldes@infomed.sld.cu
Resumen
La infección por el virus de inmunodeficiencia humana es una de las principales causas de cardiopatía adquirida, especialmente de disfunción ventricular izquierda sintomática. Se realizó una revisión bibliográfica para profundizar en los diversos elementos clínicos, fisiopatológicos y diagnósticos que caracterizan a estos pacientes. La patogénesis de la disfunción del ventrículo izquierdo se relaciona con diversos agentes causales como: la infección miocárdica por el propio virus, las infecciones oportunistas o por otros virus, mecanismos autoinmunes, deficiencias nutricionales, sobreexpresión de citocinas y toxicidad inducida por fármacos. La disfunción sistólica sintomática es una manifestación tardía de afectación cardíaca mientras que una proporción importante de pacientes presentan alteraciones clínicamente silentes. La disfunción diastólica cursa con una alteración precoz de la relajación miocárdica y de la dinámica de llenado del ventrículo izquierdo. La ecocardiografía es útil para el diagnóstico. El tratamiento antirretroviral actual incrementa la supervivencia de pacientes con infección por el virus de inmunodeficiencia humana, lo cual presumiblemente producirá un aumento en la prevalencia de complicaciones cardíacas. Se requiere de nuevos estudios prospectivos observacionales que determinen la susceptibilidad de desarrollar enfermedad cardíaca sintomática en los pacientes infectados por este virus.
Palabras clave: Virus de inmunodeficiencia humana, Ecocardiografía, Tratamiento antirretroviral altamente activo
Left ventricular dysfunction in patients with human immunodeficiency virus infection
Abstract
Infection with the human immunodeficiency virus is a major cause of acquired heart disease, especially symptomatic left ventricular dysfunction. A literature review was conducted to deepen the understanding of the various clinical, pathophysiological and diagnostic aspects that characterize these patients. The pathogenesis of left ventricular dysfunction is related to various causative agents such as: myocardial infection by the virus itself, opportunistic infections or by other viruses, autoimmune mechanisms, nutritional deficiencies, overexpression of cytokines and drug induced toxicity. Symptomatic systolic dysfunction is a late manifestation of cardiac involvement, while a significant proportion of patients have clinically silent abnormalities. Diastolic dysfunction presents with early alterations in myocardial relaxation and in left ventricular filling dynamics. Echocardiography is useful for its diagnosis. Current antiretroviral therapy increases the survival of patients infected with human immunodeficiency virus, which presumably would lead to an increase in the prevalence of cardiac complications. New prospective observational studies to determine the susceptibility of developing symptomatic heart disease in patients infected with this virus are required.
Key words: Human immunodeficiency virus, Echocardiography, Highly active antiretroviral treatment
Introducción
En 1983, según refiere Anglaret X1, el médico y virólogo francés Luc Montagnier descubre el retrovirus causante del Síndrome de Inmunodeficiencia Adquirida (SIDA) humana, al que primero llamó LAV, y que en 1986 recibe la denominación internacional de virus de inmunodeficiencia humana (VIH).
El VIH es un miembro de los lentivirus, subfamilia de los retrovirus. Representantes de este grupo pueden infectar a humanos y a primates. Estos virus tienen varias características en común: período de incubación prolongado antes de la aparición de los síntomas de la enfermedad, infección de las células de la sangre y del sistema nervioso, y afectación del sistema inmunitario2. La característica única que distingue a los retrovirus y permite su clasificación es la necesidad de transformar su información genética, que está en forma de ácido ribonucleico, en ácido dexosiribonucleico (proceso de transcripción inversa) mediante una enzima que poseen, conocida como transcriptasa inversa. Se han identificado dos especies de VIH, denominadas VIH-1 y VIH-2. El VIH-1 es el más extendido en el mundo y presenta una mayor virulencia. La distribución del VIH-2 está más limitada geográficamente, y tiene su epicentro en África occidental, aunque también existe y se propaga lentamente en la India, Portugal, Angola, Mozambique y Brasil. Tanto el VIH-1 como el VIH-2 son capaces de disminuir el número de linfocitos T cooperadores CD4+, y ocasionar SIDA en personas infectadas, aunque difieren en su historia natural3.
La infección por el VIH se caracteriza por desarrollar una inmunosupresión adquirida severa, que predispone al paciente a múltiples infecciones oportunistas, neoplasias, y a una progresiva disfunción multiorgánica. Inicialmente la afectación cardiovascular no parecía ser una complicación frecuente de la infección por el VIH, pero en los últimos años se ha descrito con mayor frecuencia4. Su prevalencia varía de 25 a 75 % en los individuos infectados y se manifiesta más a menudo en etapas avanzadas5. La introducción, en 1996, del tratamiento antirretroviral altamente activo (TARAA), modificó el curso de la infección debido a que mejoró las tasas de supervivencia y la calidad de vida de los pacientes6-8. Sin embargo, la infección en sí, las alteraciones metabólicas secundarias a dicho tratamiento y los factores de riesgo cardiovascular preexistentes pueden hacer que en pocos años este grupo de enfermos se vea afectado por una verdadera epidemia de enfermedades cardiovasculares9.
En los pacientes con VIH, la disfunción ventricular izquierda (DVI), y por consiguiente su amplio diapasón clínico, constituye uno de los hallazgos más frecuentes durante la evaluación por Cardiología. Por este motivo, la presente revisión tiene como propósito profundizar en los diversos elementos clínicos, fisiopatológicos y diagnósticos que caracterizan a la DVI en estos pacientes, para facilitar un tratamiento adecuado por sus médicos de asistencia.
ANÁLISIS DOCUMENTAL
Se revisaron, de forma exhaustiva y automatizada, los artículos relacionados con el tema, publicados en español e inglés y disponibles, en los últimos cinco años, en las bases de datos de Medline, Hinari y los repositorios internacionales de Imbiomed y Dialnet. Para ello se definieron previamente los descriptores y se incluyeron estudios que exploraban la DVI desde el punto de vista clínico, epidemiológico y ecocardiográfico. Toda la información obtenida se organizó, para su posterior análisis y síntesis.
PATOGÉNESIS
Se ha postulado una gran variedad de posibles agentes causales en la DVI secundaria a la infección por el VIH, incluyendo la infección miocárdica por el propio VIH, las infecciones oportunistas, otras de origen también viral, respuesta autoinmune, cardiotoxicidad por el tratamiento o por drogas ilícitas, deficiencias nutricionales, sobreexpresión de citoquinas y muchos otros10.
La miocarditis es la hipótesis causal mejor estudiada. Su prevalencia en individuos infectados es de 12,5 a 53 %11. El VIH es la causa específica en menos de 20 % de los casos, causas menos comunes son: toxoplasmosis, tuberculosis, candidiasis, criptococosis, histoplasmosis, citomegalovirus y herpes simple11-12. Las citocinas parecen influir significativamente en la evolución de la miocarditis, pues se han encontrado concentraciones altas de factor de necrosis tumoral alfa (FNT-α) en pacientes seropositivos con miocarditis aguda13. La mayor parte de los casos de miocarditis son clínicamente asintomáticas14. Las lesiones inflamatorias y funcionales cardíacas son similares a las evidenciadas en el virus de inmunodeficiencia del simio, estudiadas en monos Rhesus, por lo que se sugiere similar mecanismo de producción, donde las células intramiocárdicas infectadas con la proteína vírica fueron localizadas con macrófagos marcados, y se detectó que estas se encontraban en muy bajo número y no se correspondían con la cantidad de inflamación o necrosis detectada. En dicha investigación se atribuyó un importante papel a la respuesta inmunológica en la lesión miocárdica15.
Los resultados de necropsias y biopsias muestran que los infiltrados de células inflamatorias son escasos. Los viriones del VIH infectan los miocardiocitos y siguen una distribución parcheada. Las células infectadas no están rodeadas por una respuesta inflamatoria y no se ha establecido una asociación clara entre la infección y el deterioro funcional16. Sin embargo, la biopsia miocárdica puede ser clínicamente útil, ya que la presencia de infiltrados linfocitarios puede indicar la existencia de miocarditis o de infecciones oportunistas tratables (diagnóstico mediante tinciones especiales), lo que permite iniciar el tratamiento adecuado en cuanto se hace el diagnóstico. El aumento en la producción del FNT-α, altera la homeostasis intracelular del calcio y aumenta la producción de óxido nítrico, factor de crecimiento tumoral-beta y endotelina 117,18. Además, se ha demostrado experimentalmente que el óxido nítrico en altas concentraciones tiene un efecto inotrópico negativo, y es citotóxico para los miocitos.
Expertos opinan, que la introducción de TARAA se asocia a complicaciones cardiovasculares, como la aparición del síndrome metabólico, con propensión hacia el desarrollo de hiperlipidemias y de aterosclerosis coronaria19. Hruz et al.20 en sus investigaciones han demostrado que el uso clínico de inhibidores de las VIH proteasas, está asociado con insulinorresistencia y otros cambios metabólicos, que impiden la captación de la glucosa por el músculo cardíaco y aumentan el riesgo cardiovascular a largo plazo. En investigaciones con modelos de ratones transgénicos con dilatación de las cavidades cardíacas se demostró que la exposición de ritonavir, atazanavir y lopinavir precipitó un fallo cardíaco agudo y la muerte de los ratones con edema pulmonar agudo21,22. El mecanismo responsable de la disfunción cardíaca fue la sobreexposición del músculo cardíaco a la acción de la enzima cre-recombinasa23. Estos estudios, finalmente, demuestran que los inhibidores de las VIH proteasas, dañan el transporte de glucosa e inducen insuficiencia cardíaca aguda23,24.
Mayosi25, en estudios epidemiológicos sobre la disfunción cardíaca en África subsahariana, refiere que es principalmente por causas no isquémicas, como: hipertensión arterial, pericarditis, carditis reumática y miocardiopatías. Las dos enfermedades endémicas que más contribuyen a la DVI en África, son la miocardiopatía y la pericarditis. Las formas endémicas más frecuentes son la miocardiopatía dilatada (MD), la periparto y la fibrosis endomiocárdica. La MD es la más asociada a pacientes con VIH y progresa con el tratamiento inmunosupresor en los pacientes con VIH que tienen pericarditis, esta última se asocia con un gran derrame pericárdico y tuberculosis26.
Las deficiencias nutricionales son frecuentes en la infección por VIH, sobre todo en los casos de enfermedad avanzada. La malabsorción y los episodios diarreicos provocan trastornos en los electrólitos y deficiencias de nutrientes elementales. El déficit de selenio aumenta la virulencia de los virus Coxackie hacia el tejido cardíaco27. El tratamiento con selenio revierte la miocardiopatía y normaliza el funcionamiento del ventrículo izquierdo (VI) en pacientes nutricionalmente deplecionados. Los niveles de vitamina B12, carnitina y hormonas de crecimiento y tiroidea también pueden estar alterados en pacientes con infección por VIH, y se pueden asociar con DVI26.
En niños con infección por VIH trasmitida verticalmente, se han descrito dos mecanismos patogénicos. Uno es la dilatación del VI con una reducción de la proporción entre el grosor y el tamaño telediastólico del ventrículo y el otro, es la hipertrofia concéntrica del músculo con dilatación ventricular. La proporción entre el grosor y el tamaño telediastólico es normal o está aumentada28.
PRESENTACIÓN CLÍNICA Y CORRELACIÓN ECOCARDIOGRÁFICA
Los pacientes con VIH y disfunción sistólica del VI pueden estar asintomáticos, o presentar una clase funcional grado III o IV de la NYHA (siglas en inglés de la Asociación del Corazón de Nueva York), como parte del cuadro clínico de una MD29. La incidencia anual de este padecimiento se estimaba en 15,9 por 1.000 pacientes antes de la era del TARAA, y se ha reducido en 30 % tras su introducción. La MD secundaria a infección por VIH representa el 3 - 6 % de todos sus casos30.
La MD se caracteriza por una cavidad del VI dilatada y una disminución global de la función sistólica. Las dimensiones y los volúmenes diastólico y sistólico finales están de moderada a marcadamente aumentados, y las variables de la función sistólica (fracción de eyección del VI, acortamiento fraccional, volumen-latido y gasto cardíaco) están uniformemente disminuidas31. Según MacNeil et al.3, Bárbaro observó que de 952 pacientes infectados por el VIH que se encontraban asintomáticos, 76 (8 %) tuvieron MD a los 60 meses de seguimiento. La ecocardiografía transtorácica de estos pacientes mostró una hipocinesia global del VI con fracción de eyección menor de 45 %, y dilatación con índice de volumen al final de la diástole del VI mayor de 80 ml/m2. Otros rasgos secundarios evidenciados en los pacientes con MD incluyen la dilatación del anillo mitral y la coaptación incompleta de las valvas mitrales, responsables de la insuficiencia mitral funcional asociada, crecimiento de cavidades auriculares, aumento del tamaño del ventrículo derecho y presencia de trombos murales apicales32.
La MD aparece en las etapas avanzadas de la enfermedad y se relaciona con recuentos bajos (< 400/ml) de la población de linfocitos T cooperadores e inductores (linfocitos T CD4+). Lohse et al.33 demostraron que la mortalidad de los pacientes infectados por VIH con MD aumenta independientemente del recuento de los linfocitos T CD4+, la edad, el sexo o el grupo de riesgo. La mediana de supervivencia hasta la muerte relacionada con el SIDA es de 101 días en pacientes con DVI, y 472 en pacientes con un corazón normal, para un estadio similar de la infección.
En el estudio P2C2, citado por Bradley et al.34, la mediana de edad de los niños infectados por VIH fue de 2,1 años y la supervivencia acumulada a los 5 años fue del 64 %. La mortalidad fue mayor en los niños que al inicio del estudio tenían disminución del acortamiento fraccional del VI, o aumento del tamaño del mismo ventrículo, del grosor, de la masa, del estrés de la pared, de la frecuencia cardíaca o la tensión arterial. La disminución del acortamiento fraccional del VI y el aumento del grosor de la pared también fueron factores que condicionaron la supervivencia después de ajustarlos para la edad, talla, recuento de linfocitos CD4+, carga viral del VIH, hospital y presencia o no de encefalopatía. El acortamiento fraccional fue anormal desde tres años antes del fallecimiento, mientras que el engrosamiento de la pared identificó a la población de riesgo solo de 18 a 24 meses antes del fallecimiento. La rápida aparición de insuficiencia cardíaca tiene un pronóstico ominoso, tanto en adultos como en niños con infección por VIH, ya que más de la mitad de los pacientes mueren por insuficiencia cardíaca primaria entre 6 y 12 meses desde el diagnóstico.
La DVI no se limita a una afectación de la sístole ventricular. Los hallazgos clínicos y ecocardiográficos sugieren que la disfunción diastólica es relativamente frecuente en los supervivientes a largo plazo con infección por VIH. Esta disfunción puede preceder a la disfunción sistólica del VI. Por esta razón, el análisis incruento de la función diastólica en pacientes infectados por el VIH y asintomáticos desde el punto de vista cardiovascular, puede ser utilizado como herramienta de cribado para detectar alteraciones precoces del llenado ventricular que sugieren afectación miocárdica35.
Existen diversas técnicas ecocardiográficas para evaluar la función diastólica del VI. En la práctica actual las de mayor utilidad clínica son las técnicas con Doppler, que evalúan el flujo mitral y el de las venas pulmonares, así como la realización del Doppler tisular o hístico (DTI) a nivel del anillo de la válvula mitral32 (Figura 1). El flujo mitral normal es un flujo bifásico desde la aurícula izquierda hasta el VI. En un individuo sano el flujo inicial que coincide con la onda E mitral excede al tardío, que ocurre junto con la sístole auricular (la onda A), tanto en velocidad como en volumen36. La magnitud de estos flujos, así como su relación, varía con la edad de la población normal. En las personas jóvenes y sanas la onda E es mayor que la A y por ende, la relación E/A es mayor de 1 (Figura 2). En los adultos jóvenes puede haber una contribución desproporcionada de la relajación ventricular activa al llenado ventricular, lo que resulta en una velocidad de la onda E muy acentuada. En este caso la relación E/A puede exceder un valor de 2. En diversas situaciones clínicas, como la infección por el VIH se produce una rigidez del ventrículo, que da como resultado una relajación retardada. Esto genera una disminución progresiva de la velocidad de la onda E y un aumento de la velocidad de la onda A de manera que la relación E/A puede tomar un valor inferior a 137. Por otra parte, lo anterior se acompaña de una prolongación del tiempo de desaceleración de la onda E y de un alargamiento del tiempo de relajación isovolumétrica. Este tiempo representa la primera fase de la diástole, se define como el tiempo transcurrido desde el cierre de la válvula aórtica hasta la apertura de la válvula mitral y en los adultos, normalmente promedia unos 76 ± 13 m/s38. En el estudio multicéntrico Corazón y VIH39 se realizó ecocardiografía a pacientes con infección por VIH asintomáticos y se encontró que tenían una relación E/A 34,6 % más baja de lo normal, y un tiempo de relajación isovolumétrica 19,7 % más elevado de lo normal en comparación con los adultos sanos.
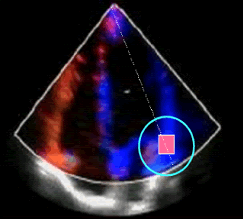
Figura 1. Ecocardiograma. Vista apical de cuatro cámaras. El cuadrado representa el sitio de colocación del volumen muestra durante la realización del DTI del anillo mitral.
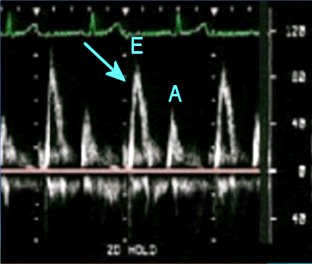
Figura 2. Flujograma mitral de un paciente joven donde se observa una relación E/A mayor de 1.
Los pacientes con MD muy avanzada o descompensada pueden mostrar un patrón de llenado diastólico restrictivo a causa de la disminución de la distensibilidad y el aumento de las presiones de llenado del VI. A medida que se trata la insuficiencia cardíaca de un paciente con MD, el llenado diastólico se vuelve menos restrictivo. La persistencia de un llenado restrictivo tras el tratamiento se asocia con elevadas mortalidad y tasa de transplante40.
El estado de la presión en la arteria pulmonar, estimado a partir de la velocidad de regurgitación de la válvula tricúspide, es también pronóstico en la MD secundaria a la infección por VIH37. Los pacientes con velocidad de insuficiencia tricúspide superior a los 3 m/s presentan una mayor mortalidad, una incidencia más elevada de insuficiencia cardíaca, e ingresos más frecuentes que aquellos con una velocidad inferior.
En el campo de la diastología, el DTI del anillo mitral medial y lateral, o ambos, se ha consolidado como una técnica con la suficiente consistencia a la hora de evaluar la función diastólica del VI. En aquellos pacientes con infección crónica por el VIH y estados de relajación del VI anormal, la constante hemodinámica tau se encuentra prolongada. El patrón de velocidades del anillo mitral con DTI varía, y muestra una disminución de la onda e´ y una onda a´ predominante. El DTI del anillo mitral refleja la alteración de la función diastólica con una sensibilidad superior a la del Doppler transmitral o al estudio de Doppler del retorno venoso pulmonar, y no es modificado por las variaciones de la precarga41.
Todavía son escasos los trabajos que estudian la función diastólica en la infección por el VIH. Little et al.42 describen la alteración del patrón de llenado inicial del VI y la prolongación del tiempo de relajación isovolumétrica en pacientes menores de 50 años portadores del VIH (asintomáticos y sintomáticos) en comparación con un grupo control sano, pero no hacen referencia a la situación inmunológica o al recuento de linfocitos CD4+. Por el contrario, Aljaroudi et al.43 incluyen en su estudio pacientes africanos asintomáticos, con cifras de linfocitos CD4+ < 300/ml, y confirman la alteración del patrón de llenado del VI y su relación significativa con la situación inmunológica. Esta alteración fue de tipo restrictivo y se atribuyó a la presencia de hipertrofia concéntrica del VI o a la infiltración cardíaca en el curso de una amiloidosis sistémica.
TRATAMIENTO
El tratamiento de la DVI secundaria a una MD por VIH es similar al de su forma idiopática e incluye la utilización de diuréticos, digoxina e inhibidores de la enzima conversora de la angiotensina, según sean tolerados. No hay estudios que investiguen la eficacia de tratamientos específicos para el corazón, excepto con inmunoglobulina intravenosa. Por su parte, el TARAA disminuye la tasa de mortalidad por insuficiencia cardíaca44.
Las inmunoglobulinas han tenido cierto éxito en casos de miocardiopatía congestiva aguda y ante miocarditis inespecíficas en pacientes sin infección por VIH. Este tratamiento es beneficioso en pacientes con enfermedad de Kawasaki, un trastorno de origen inmunológico con disfunción cardíaca similar a la de la infección por VIH45. La infusión mensual de inmunoglobulinas en pacientes pediátricos con cardiopatía asociada al VIH ha conseguido minimizar la DVI, aumentar el grosor de la pared ventricular y reducir el estrés máximo de la pared del VI, lo que sugiere que, tanto el crecimiento anormal del miocardio como la DVI, pueden tener un mediador inmunológico. El aparente efecto de las inmunoglobulinas puede deberse a su capacidad de eliminar autoanticuerpos del corazón y disminuir la secreción o los efectos de las citocinas y los factores de crecimiento celular. Los casos con concentraciones plasmáticas altas de citocinas proinflamatorias tienen mal pronóstico, el tratamiento inmunomodulador puede ser útil en situaciones especiales, o en niños con deterioro progresivo de la función del VI. Será necesaria la realización de un estudio multicéntrico, aleatorio, para evaluar la eficacia de este tratamiento45.
El tratamiento agresivo de las infecciones (oportunistas o no) puede mejorar la evolución y el pronóstico de la MD. Por otra parte, se impone estudiar a fondo el estado nutricional de los pacientes y aportar suplementos si existiese algún déficit (selenio, carnitina, o multivitaminas, solos o combinados, en pacientes anoréxicos o en aquellos con caquexia o síndromes diarreicos)46. Después del inicio del tratamiento médico, hay que realizar ecocardiografías seriadas cada cuatro meses, si la función cardíaca o el curso clínico se deterioran, hay que considerar la realización de una biopsia del ventrículo derecho.
CARDIOTOXICIDAD POR FÁRMACOS
Los pacientes con infecciones oportunistas o cáncer reciben fármacos que pueden ocasionar toxicidad cardiovascular. Se informa que existe relación entre la administración de zidovudina y la MD; este antirretroviral se relaciona con la destrucción difusa de ultraestructuras celulares e inhibición de la replicación del ADN mitocondrial, lo que ocasiona acidosis láctica que contribuye a la disfunción miocárdica47. También se han descrito arritmias ventriculares como: taquicardia, fibrilación y taquicardia ventricular atípica (relacionadas con la prolongación del intervalo QTc); y alteraciones de la conducción aurículo-ventricular con la administración de fármacos como: anfotericina B, ganciclovir, trimetoprima-sulfametoxazol y pentamidina48. Además, con la combinación lopinavir-ritonavir se han comunicado casos de bloqueo aurículo-ventricular, particularmente cuando se administra junto con fármacos que prolongan el intervalo QT del electrocardiograma49.
La administración conjunta de atazanavir y macrólidos puede prolongar el intervalo QT corregido50, la doxorrubicina, el interferón α y el foscarnet son cardiotóxicos; y el alcohol y la cocaína pueden agravar la disfunción ventricular en este tipo de pacientes51.
EPÍLOGO
Es importante señalar que el tratamiento antirretroviral actual incrementa la supervivencia de pacientes con infección por el VIH, lo cual presumiblemente producirá un aumento en la incidencia y prevalencia de complicaciones cardíacas; por lo tanto, se requiere de nuevos estudios prospectivos observacionales que determinen la susceptibilidad de desarrollar enfermedad cardíaca sintomática en los pacientes infectados por el VIH.
Referencias bibliográficas
Anglaret X. Global AIDS epidemic: from epidemiology to universal treatment. Rev Med Interne. 2008;29 Suppl 3:S269–73.
Alonso–Villaverde Lozano C. Physiopathology of cardiovascular disease in HIV–infected patients. Enferm Infecc Microbiol Clin. 2009;27 Suppl 1:33–9.
MacNeil A, Sarr AD, Sankalé JL, Meloni ST, Mboup S, Kanki P. Direct evidence of lower viral replication rates in vivo in human immunodeficiency virus type 2 (HIV–2) infection than in HIV–1 Infection. J Virol. 2007;81(10):5325–30.
Boccara F. Cardiovascular complications and atherosclerotic manifestations in the HIV–infected population: type, incidence and associated risk factors. AIDS. 2008;22 Suppl 3:S19–26.
El Hattaoui M, Charei N, Boumzebra D, Aajly L, Fadouach S. Prevalence of cardiomyopathy in HIV infection: prospective study on 158 HIV patients. Med Mal Infect. 2008;38(7):387–91.
Chan PA, Wakeman SE, Flanigan T, Cu–Uvin S, Kojic E, Kantor R. HIV–2 diagnosis and quantification in high–risk patients. AIDS Res Ther. 2008;5:18.
Fang CT, Chang YY, Hsu HM, Twu SJ, Chen KT, Lin CC, et al. Life expectancy of patients with newly–diagnosed HIV infection in the era of highly active antiretroviral therapy. QJM. 2007; 100(2):97–105.
Hogg R, Lima V, Sterne JA, Grabar S, Battegay M, Bonarek M, et al. Life expectancy of individuals on combination antiretroviral therapy in high–income countries: a collaborative analysis of 14 cohort studies. Lancet. 2008;372(9635):293–9.
Bernardino de la Serna JI, Arribas López JR. Controversies and future of the approach to cardiovascular disease in HIV patients. Enferm Infecc Microbiol Clin. 2009;27 Suppl 1:48–53.
Barelli S, Angelillo–Scherrer A, Foguena AK, Periard D, Cavassini M. Controversies regarding the pathogenesis of cardiovascular diseases in HIV patients. Rev Med Suisse. 2011;7(292):905–10.
Rogers JS, Zakaria S, Thom KA, Flammer KM, Kanno M, Mehra MR. Immune reconstitution inflammatory syndrome and human immunodeficiency virus–associated myocarditis. Mayo Clin Proc. 2008;83(11):1275–9.
Kindermann I, Kindermann M, Kandolf R, Klingel K, Bültmann B, Müller T, et al. Predictors of outcome in patients with suspected myocarditis. Circulation. 2008;118(6):639–48.
Huang CH, Vallejo JG, Kollias G, Mann DL. Role of the innate immune system in acute viral myocarditis. Basic Res Cardiol. 2009;104(3):228–37.
Kyto V, Saraste A, Voipio–Pulkki LM, Saukko P. Incidence of fatal myocarditis: a population–based study in Finland. Am J Epidemiol. 2007; 165(5):570–4.
Elamm C, Fairweather D, Cooper LT. Republished: Pathogenesis and diagnosis of myocarditis. Postgrad Med J. 2012;88(1043):539–44.
Uriel N, Jorde UP, Cotarlan V, Colombo PC, Farr M, Restaino SW, et al. Heart transplantation in human immunodeficiency virus–positive patients. J Heart Lung Transplant. 2009;28(7):667–9.
Thorin E, Clozel M. The cardiovascular physiology and pharmacology of endothelin–1. Adv Pharmacol. 2010;60:1–26.
Habib S, Ali A. Biochemistry of nitric oxide. Indian J Clin Biochem. 2011;26(1):3–17.
Avelino–Silva VI, Ho YL, Avelino–Silva TJ,Santos S de S. Aging and HIV infection. Ageing Res Rev. 2011;10 (1):163–72.
Hruz PW, Yan Q, Struthers H, Jay PY. HIV protease inhibitors that block GLUT4 precipitate acute, decompensated heart failure in a mouse model of dilated cardiomyopathy. FASEB J. 2008;22(7):2161–7.
Capel E, Auclair M, Caron–Debarle M, Capeau J. Effects of ritonavir–boosted darunavir, atazanavir and lopinavir on adipose functions and insulin sensitivity in murine and human adipocytes. Antivir Ther. 2012;17(3):549–56.
Boger MS, Shintani A, Redhage LA, Mitchell V, Haas DW, Morrow JD, et al. Highly sensitive C–reactive protein, body mass index, and serum lipids in HIV–infected persons receiving antiretroviral therapy: a longitudinal study. J Acquir Immune Defic Syndr. 2009;52(4):480–7.
Arribas JR. Drugs in traditional drug classes (nucleoside reverse transcriptase inhibitor / nonnucleoside reverse transcriptase inhibitor / protease inhibitors) with activity against drug–resistant virus (tipranavir, darunavir, etravirine).Curr Opin HIV AIDS. 2009;4(6):507–12.
Taiwo B, Murphy RL, Katlama C. Novel antiretroviral combinations in treatment–experienced patients with HIV infection: rationale and results. Drugs. 2010;70(13):1640–42.
Mayosi BM. Contemporary trends in the epidemiology and management of cardiomyopathy and pericarditis in sub–Saharan Africa. Heart. 2007; 93(10):1176–83. 26. Cowie MR. Recent developments in the management of heart failure. Practitioner. 2012;256(1752):25–9, 3.
El Amari EB, Hirschel B. HIV–AIDS 2008: the year in review. Rev Med Suisse. 2009;5(185):69–71.
Okoromah CA, Ojo OO, Ogunkunle OO. Cardiovascular dysfunction in HIV–infected children in a sub–Saharan African country: Comparative Cross–sectional observational study. J Trop Pediatr. 2012;58(1):3–11.
Lot F. Epidemiology of HIV/AIDS and other sexually transmitted diseases in women. Med Sci (Paris). 2008;24(2):7–19.
Sani MU. Myocardial disease in human immunodeficiency virus (HIV) infection: a review. Wien Klin Wochenschr. 2008;120(3–4):77–87.
Binkley PF, Lesinski A, Ferguson J, Hatton PS, Yamokoski L, Hardikar S, et al. Recovery of normal ventricular function in patients with dilated cardiomyopathy: predictors of an increasingly prevalent clinical event. Am Heart J. 2008;155(1):69–74.
Mizuno H, Ohte N, Wakami K, Narita H, Fukuta H, Asada K, et al. Peak mitral annular velocity during early diastole and propagation velocity of early diastolic filling flow are not interchangeable as the parameters of left ventricular early diastolic function. Am J Cardiol. 2008;101(10):1467–71.
Lohse N, Hansen AB, Pedersen G, Kronborg G, Gerstoft J, Sorensen HT, et al. Survival of persons with and without HIV Infection in Denmark, 1995–2005. Ann Inter Med. 2007;16;146(2):87–95.
Fetzer BC, Hosseinipour MC, Kamthuzi P, Hyde L, Bramson B, Jobarteh K, et al. Predictors for mortality and loss to follow–up among children receiving anti–retroviral therapy in Lilongwe, Trop Med Int Health. 2009;14(8):862–9.
Luers C, Maisch B. Echocardiography: future developments. What is diastole and how to assess it? Impaired left ventricular systolic function. Minerva Cardioangiol. 2011;59(4):331–47.
Borbély A, Papp Z, Edes I, Paulus WJ. Review Molecular determinants of heart failure with normal left ventricular ejection fraction. Pharmacol Rep. 2009;61(1):139–45.
Rovner A, Waggoner AD, Mathews SJ, Dávila–Román VG, de las Fuentes L. Role of tissue Doppler and color M–mode imaging for evaluation of diastolic function in ambulatory patients with LV systolic dysfunction.Echocardiography. 2007;24(5):478–84.
Stewart KC, Kumar R, Charonko JJ, Ohara T, Vlachos PP, Little WC. Evaluation of LV diastolic function from color M–mode echocardiography. JACC Cardiovasc Imaging. 2011;4(1):37–46.
Reinsch N, Kahlert P, Esser S, Sundermeyer A, Neuhaus K, Brockmeyer N, et al. Echocardiographic findings and abnormalities in HIV–infected patients: results from a large, prospective, multicenter HIV–heart study. Am J Cardiovasc Dis. 2011;1(2):176–84.
Previtali M, Chieffo E, Ferrario M, Klersy C. Echocardiographic evaluation of left ventricular diastolic function: correlation between echocardiographic and hemodynamic parameters.Minerva Cardioangiol. 2007;55(6):733–40.
Kheradvar A, Gharib M. On mitral valve dynamics and its connection to early diastolic flow.Ann Biomed Eng. 2009; 37(1):1–13.
Little WC, Oh JK. Echocardiographic evaluation of diastolic function can be used to guide clinical care. Circulation. 2009;120(9):802–9.
Aljaroudi W, Alraies MC, Halley C, Rodríguez L, Grim RA, Thomas JD, et al. Impact of progression of diastolic dysfunction on mortality in patients with normal ejection fraction. Circulation. 2012;125(6):782–8.
Hogg R, Lima V, Sterne JA, Grabar S, Battegay M, Bonarek M, et al. Life expectancy of individuals on combination antiretroviral therapy in high–income countries: a collaborative analysis of 14 cohort studies. Lancet. 2008; 372(9635):293–9.
Goland S, Czer LS, Siegel RJ, Tabak S, Jordan S, Luthringer D, et al. Intravenous immunoglobulin treatment for acute fulminant inflammatory cardiomyopathy: Series of six patients and review of literature. Can J Cardiol. 2008; 24(7):571–4.
Kramer AS, Lazzarotto AR, Sprinz E, Manfroi WC. Metabolic abnormalities, antiretroviral therapy and cardiovascular disease in elderly patients with HIV. Arq Bras Cardiol. 2009;93(5):561–8.
Susan–Resiga D, Bentley AT, Lynx MD, LaClair DD, McKee EE. Zidovudine inhibits thymidine phosphorylation in the isolated perfused rat heart. Antimicrob Agents Chemother. 2007;51(4):1142–9.
Braithwaite RS, Kozal MJ, Chang CC, et al. Adherence, virological and immunological outcomes for HIV–infected veterans starting combination antiretroviral therapies. AIDS. 2007;21:1579–89.
Von Hentig N. Lopinavir/ritonavir: appraisal of its use in HIV therapy. Drugs Today. 2007;43(4):221–47.
Cossarini F, Salpietro S, Galli L, Gianotti N, Nozza S, Spagnuolo V et al. Monotherapy with atazanavir as a simplification strategy: results from an observational study. Acquir Immune Defic Syndr. 2012;60(3):101–3.
Boufassa F, Goujard C, Viard JP, Carlier R, Lefebvre B, Yeni P, et al. Immune deficiency could be an early risk factor for altered insulin sensitivity in antiretroviral–naive HIV–1–infected patients: the ANRS COPANA cohort. Antivir Ther. 2012;17(1):91–100.
Recibido: 13 de septiembre de 2012
Versión corregida: 21 de diciembre de 2012
Aceptado: 14 de enero de 2013
Subir






















