CorSalud 2012 Oct-Dic;4(4):287-293
ARTÍCULO DE REVISIÓN
EL SISTEMA RENINA−ANGIOTENSINA DESDE LA CIRCULACIÓN HASTA LA CÉLULA: IMPLICACIONES MÁS ALLÁ DE LA HIPERTENSIÓN
Dr. Yosit Ponce Gutiérrez1 y Dr. Arik Ponce Gutiérrez2
______________
Médico General. Destacamento "Mario Muñoz Monroy". Policlínico Juan B. Contreras Fowler. Ranchuelo. Villa Clara, Cuba.
Especialista de I Grado en Medicina General Integral. Policlínico "Juan B. Contreras Fowler". Ranchuelo. Villa Clara, Cuba
Correspondencia: Y Ponce Gutiérrez. Camilo Cienfuegos N° 63, entre Carmen Rivero y Federico Escobar. Ranchuelo, Villa Clara, Cuba. Teléfono: 452826. Correo electrónico: yositpg@edu.vcl.sld.cu, froilanponce@capiro.vcl.sld.cu
Resumen
El sistema renina-angiotensina es más complejo de lo que se conocía hasta hace poco tiempo, ya que su acción no solo se circunscribe al plasma sanguíneo, sino que igualmente se ha demostrado su existencia en tejidos como: corazón, cerebro, riñón, páncreas, aparato reproductor, sistema linfático y el tejido adiposo; con acciones activas específicas en todos ellos, y al mismo tiempo está presente en el interior de diferentes tipos de células, como cardiomiocitos y fibroblastos. Constituye un sistema endocrino, paracrino y autocrino que es capaz de actuar a sus diferentes niveles de manera independiente o relacionada, y participa no solo en el control de la presión arterial y homeostasis del agua y sodio como se le atribuía inicialmente, sino que también interviene en el correcto funcionamiento de numerosos órganos, así como en el mecanismo fisiopatológico de alteraciones estructurales y funcionales, fundamentalmente cardiovasculares y renales que van mucho más allá de la hipertensión arterial.
Palabras clave: Sistema Renina-Angiotensina, Fenómenos Fisiológicos Celulares
Abstract
The renin-angiotensin system is more complex than was known until recently, since its action is not only limited to the plasma. Its presence has been shown in tissues such as the heart, brain, kidney, pancreas, reproductive system, lymphatic system and adipose tissue, with specific active actions in all of them, and at the same time it is present at the intracellular level of different cell types such as cardiomyocytes and fibroblasts. It is an endocrine, paracrine and autocrine system which is capable of acting at different levels in an independent or related form, taking part not only in the control of blood pressure and homeostasis of water and sodium as initially attributed, but it is also involved in the proper functioning of numerous organs and in the pathophysiological mechanism of structural and functional alterations, mainly cardiovascular and renal, which go far beyond hypertension.
Key words: Renin-Angiotensin System, Cell Physiological Phenomena
Introducción
Las actividades fisiológicas del Sistema Renina-Angiotensina (SRA) siguen ampliándose mucho tiempo después de su descubrimiento en 1898, por el fisiólogo finlandés Robert Tigerstedt y su estudiante sueco Per Bergman, con la identificación de nuevos componentes, funciones y subsistemas; sin embargo, a pesar de que los conocimientos sobre el tema han aumentado, no podemos todavía plantear que se haya esclarecido totalmente1. Se ha puesto sucesivamente en evidencia que, además del SRA clásico o plasmático, existe un SRA local o hístico en la mayoría de los órganos y tejidos estudiados, que va mucho más allá al describirse recientemente el SRA intracelular1-3.
Esto no sólo convierte al SRA en un sistema endocrino, sino también en paracrino y autocrino. Las recientemente reconocidas Angiotensina (Ang) III (Ang 2-8 heptapéptido) y la Ang IV (Ang 3-8 hexapéptido), han demostrado ser biológicamente activas al igual que la Ang II. La angiotensina 1-7 heptapéptido (Ang 1-7) parece jugar un importante papel que contrarresta muchas acciones de la Ang II. Las acciones de la angiotensina II y Ang III sólo son mediadas por los receptores AT1 y AT2, pero estos no constituyen los únicos que forman parte del sistema, ya que las investigaciones actuales han revelado los receptores funcionales específicos para la Ang IV, la Ang 1-7, y quizás más sorprendentemente, para la renina-prorrenina1.
Por consiguiente, de esto se deduce que el SRA es bastante complejo y enredado, y que solamente, en la medida que se conozca más a profundidad cómo interactúan cada uno de sus componentes y las funciones que desempeñan, se podrán dilucidar mejores conductas preventivas y terapéuticas, no solo para la hipertensión arterial, sino también para toda una gama de afecciones estructurales cardiovasculares y renales en que este sistema tiene un papel fisiopatológico.
La presente revisión se realiza con el objetivo de describir la fisiología del SRA plasmático, hístico e intracelular, y las principales alteraciones asociadas. Las fuentes principales las constituyeron dos excelentes artículos que aparecen en el Journal of Internal Medicine1 y en la Revista Española de Cardiología2, de los que se utilizan textos y figuras, y se les incluyen nuestras opiniones.
SRA PLASMÁTICO O CLÁSICO
El SRA clásico o plasmático tiene un importante papel en la regulación de la presión arterial (PA) por medio de la liberación de Ang II y el equilibrio hidrosalino, a través de la liberación de aldosterona. Normalmente, el SRA actuaría como un mecanismo de defensa que se activaría en respuesta a una hipotensión hipovolémica. Cuando la PA disminuye como resultado de la restricción de sodio o hipovolemia, las células yuxtaglomerulares del riñón sintetizan una enzima, la renina, que se libera a la sangre circulante4.
La renina rompe el enlace existente entre Leu-10 y Val-11 del angiotensinógeno (AGT), glucoproteína β2 plasmática de 453 aminoácidos (55-61 kDa) sintetizada en el hígado, la que produce un decapéptido inactivo, la Ang I, la cual recibe la acción de la ECA, secretada por las células endoteliales de los pulmones, fundamentalmente, y de los riñones, e hidroliza el dipéptido terminal His−9−Leu−10 de la Ang I y la convierte en un octapéptido activo, la Ang II. Esta estimula los receptores AT1 y AT2, y produce una respuesta vasoconstrictora (que incrementa las resistencias vasculares periféricas y la PA), aumenta la actividad del sistema simpático, estimula la liberación de vasopresina, incrementa el cronotropismo cardíaco, y favorece la aparición de cambios en la funciones glomerular y tubular del riñón, con un aumento en la liberación de aldosterona por la corteza suprarrenal que es la que produce retención renal de sodio y agua, con lo que aumenta aún más la PA.
Estas acciones permiten restaurar la volemia y la PA. A su vez, la propia Ang II estimula los receptores AT1 en las células yuxtaglomerulares y produce una inhibición de la síntesis y la liberación de renina a este nivel, con lo que se regula la activación del SRA (Figura 1)1,5.
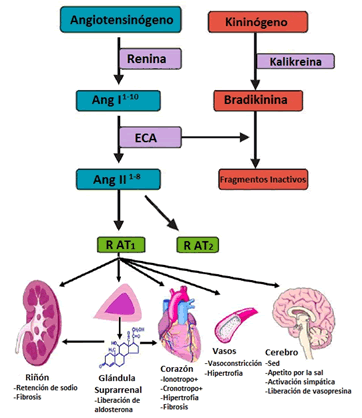
Figura 1. SRA clásico. Angiotensina (Ang); Enzima conversora de angiotensina (ECA); Receptor de la Angiotensina 1 (R AT1) y Receptor de la Angiotensina 2 (R AT2). Tomada de: Fyhrquist F, Saijonmaa O. J Intern Med 2008; 264: 224-361. Adaptada y modificada por los autores.
SRA LOCAL O HÍSTICO
Uno de los avances más significativos de las últimas dos décadas es el descubrimiento de los SRA locales o hísticos. Un sistema local se caracteriza por la presencia de sus componentes (AGT y las enzimas de conversión), por la síntesis local de Ang II y otros péptidos de la Ang, y por su unión a receptores específicos, además de receptores de renina-prorrenina, con el resultado de una respuesta fisiológica local (Figura 2). Los estudios indican que la mayoría o casi toda la renina encontrada en los SRA locales se deriva de la renina renal5. Los sistemas locales están regulados independientemente del SRA sistémico, pero pueden interactuar con él. Se han identificado SRA locales en el corazón, riñón, cerebro, páncreas, aparato reproductor, sistema linfático y el tejido adiposo2,6,7. Algunas de las funciones locales del SRA son tan variadas como el crecimiento y el remodelado del corazón, la regulación de la presión arterial, la estimulación del apetito o la secreción hormonal pancreática2,7.
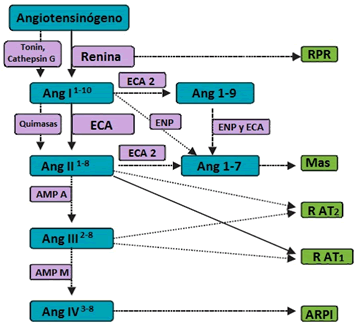
Figura 2. Esquema del SRA local. ( ): Indican las vías que han sido demostradas clínicamente. (
): Indican las vías que han sido demostradas clínicamente. ( ): Indican las vías que han sido probadas en experimentos animales y cultivos celulares, no de forma conclusiva clínicamente. AMP (aminopeptidasa); Ang (angiotensina); ARPI (aminopeptidasa regulada por insulina, que es el receptor de R AT4 de la Ang IV); ECA (Enzima Conversora de Angiotensina); ENP (endopeptidasa neutral); Mas (Oncogén Mas, que es el receptor para la Ang 1-7); R AT1 (receptor de la Ang I); R AT2 (receptor de la Ang II); RPR (receptor de renina-prorrenina). Tomada de: Fyhrquist F, Saijonmaa O. J Intern Med 2008; 264: 224-361. Modificada por los autores.
): Indican las vías que han sido probadas en experimentos animales y cultivos celulares, no de forma conclusiva clínicamente. AMP (aminopeptidasa); Ang (angiotensina); ARPI (aminopeptidasa regulada por insulina, que es el receptor de R AT4 de la Ang IV); ECA (Enzima Conversora de Angiotensina); ENP (endopeptidasa neutral); Mas (Oncogén Mas, que es el receptor para la Ang 1-7); R AT1 (receptor de la Ang I); R AT2 (receptor de la Ang II); RPR (receptor de renina-prorrenina). Tomada de: Fyhrquist F, Saijonmaa O. J Intern Med 2008; 264: 224-361. Modificada por los autores.
En el SRA cardíaco, la expresión de la ECA aumenta en el corazón infartado, la insuficiencia cardíaca y durante el tratamiento con inhibidores de la ECA o antagonistas de los receptores de Angiotensina (ARA)8. La ECA 2 es la generadora principal de Ang 1-7 a partir de Ang II en el corazón, y la cantidad de Ang 1-7 aumenta en el área peri-isquémica después del infarto del miocardio9.
Los componentes del SRA cerebral median una gran variedad de funciones neurobiológicas que poco a poco han ido comprendiéndose10. Por ejemplo, los receptores AT1 neuronales median las acciones que ejerce la Ang II sobre la PA, como la ingestión de sal, agua, y la liberación de vasopresina, mientras que los receptores AT2 intervienen en la apoptosis y la regeneración neural. Además las Ang II, Ang III, Ang IV y Ang 1-7 parecen estar involucradas en la modulación de funciones del cerebro, entre ellas el aprendizaje y respuestas de memoria10.
El tejido adiposo también contiene todos los componentes del SRA, que incluye receptores de renina-prorrenina que parecen estar involucrados en la regulación de la acumulación del tejido adiposo visceral. De esto se deduce que el SRA de este tejido puede ser importante en la fisiopatología del síndrome metabólico. El tejido adiposo es considerado como una fuente importante de AGT local y circulante, y podría participar por eso en la regulación de la PA sistémica. Sin embargo, esto no se ha demostrado aún en humanos11.
La ECA testicular, una isoforma pequeña de la ECA, se cree que desempeña un papel crucial en la fertilización, ya que participa en la liberación de la proteína glycosylphosphatidylinositol anclada a las células espermáticas12, las que con poca ECA muestran una unión deficiente con el óvulo durante la fecundación. El impacto de esta observación está sujeto a un estudio más profundo. Sin embargo, en el tratamiento con los inhibidores de la ECA no se ha registrado que interfiera en la reproducción masculina12.
Vías alternativas en la generación de Ang II
La Ang II puede generarse enzimáticamente a partir de la Ang I por acción de las quimasas en ciertas condiciones patológicas (Figura 2). Las quimasas se almacenan en complejos macromoleculares con el proteoglicano de la heparina en los gránulos secretorios de los mastocitos. Para ponerse enzimáticamente activas, las quimasas deben soltarse de los complejos de los gránulos de los mastocitos, como ocurre por ejemplo cuando hay una lesión vascular u otro tipo de daño. Por tanto, las quimasas son enzimáticamente inactivas en el tejido vascular normal y sólo puede producir Ang II si se produce lesión o aterosclerosis de las paredes arteriales. Cabe señalar que los inhibidores de las proteasas de la serina endógena presentes en el fluido intersticial son potentes inhibidores de las quimasas13.
Angiotensina 2-8 heptapéptido (Ang III)
De la Ang III es bien conocido, desde los años setenta, que causa vasoconstricción y liberación de aldosterona. Se genera de la Ang II por acción de la aminopeptidasa A (Figura 2). La Ang III ejerce sus acciones por un principio similar al de la Ang II, a través de los receptores AT1 y AT2. Aunque la Ang II es considerada la principal efectora del SRA, la Ang III puede ser tan o más importante en algunas acciones mediadas por los receptores AT1, como por ejemplo en la liberación de la vasopresina14.
Angiotensina 3-8 hexapéptido (Ang IV)
La Ang IV puede ser generada a partir de la Ang III por acción de la aminopeptidasa M (Figura 2). Este péptido, con actividad biológica activa, ha aumentado su interés con el descubrimiento y la duplicación de los receptores de las aminopeptidasas regulados por insulina (ARPI), ya que estos últimos son un sitio de unión y posible receptor AT4 de la Ang IV15. Las acciones de Ang IV mediados por el ARPI, incluyen vasodilatación renal, hipertrofia y activación del factor nuclear ƙB (NF-ƙB), que lleva a la expresión aumentada del inhibidor del activador de plaquetas 1, proteína quimiotática del monocito, interleukina-6, móleculas de adhesión proinflamatorias y factor de necrosis tumoral α. Varios estudios sugieren que la Ang IV tiene importantes funciones reguladoras en la cognición, metabolismo renal y daño cardiovascular. La Ang IV regula el crecimiento celular de los fibroblastos cardíacos, células endoteliales y células del músculo liso vascular; está involucrada en la respuesta vascular inflamatoria y podría estar implicada por tanto, en la fisiopatología cardiovascular16.
Angiotensina 1-7 heptapéptido
La Ang 1-7 heptapéptido durante mucho tiempo se pensó que estaba desprovista de acciones en el organismo, hasta los informes actuales sobre sus efectos biológicos17. La relevancia de la Ang 1-7 surge con el descubrimiento de la ECA 2. Esta enzima genera Ang 1-7 a partir de la Ang II. La Ang 1-7 también puede obtenerse de la Ang I o Ang II por acción de otras peptidasas (Figura 2). La Ang 1-7 presenta acciones opuestas a las de la Ang II (Figura 3), como vasodilatación, antihipertrofia, y la amplificación de la vasodilatación causada por la bradikinina. Los experimentos hacen pensar que existe una interacción importante entre la Ang 1-7 y el sistema prostaglandina-bradikinina-óxido nítrico. La Ang 1-7 se une a un receptor que media, las acciones vasodilatadoras y antiproliferativas del heptapéptido17.
Figura 3. Efectos de los péptidos de Angiotensina y la renina-prorrenina mediados por sus receptores correspondientes. Ang (Angiotensina); ARPI (aminopeptidasa regulada por insulina); ICAM-1 (móleculas de adhesión proinflamatorias); IL-6 (interleucina 6); Mas (Oncogen Mas); MCP-1 (Proteína quimiotática del monocito); NF-kappaB (Factor nuclear B); PAI-1 (Inhibidor del activador de plaqueta); R AT1 (receptor de la Ang I); R AT2 (receptor de la Ang II); RPR (receptor de renina-prorrenina); TNF-alpha (Factor de necrosis tumoral α). Tomada de: Fyhrquist F, Saijonmaa O. J Intern Med 2008; 264: 224-361. Modificada por los autores.
Enzima conversora de angiotensina 2
La ECA 2 es una carboxypeptidasa que se une a un residuo de Ang I para generar Ang 1-9, y a un residuo de Ang II para formar Ang 1-7 (Figura 2). La ECA 2 es muy abundante en el endotelio vascular del riñón, corazón, hipotálamo y pared aórtica; además de estar presente en los testículos. La ECA 2 y la Ang 1-7 tienen un papel cardinal en la fisiología y patología cardiovasculares, ya sea modulando o contrapesando la actividad aumentada del SRA clásico18.
SRA INTRACELULAR
El SRA intracelular se define como la presencia de síntesis y efectos biológicos de la Ang II en una localización intracelular2. La existencia de formas glucosiladas de AGT y de renina diferentes, como consecuencia de la escisión alternativa, de formas de ECA intracelulares y secretadas, y enzimas alternativas para la síntesis de Ang II, como las catepsinas y las quimasas; y, finalmente, la detección de esos componentes en el espacio intracelular, apoyarían la hipótesis de que existe un SRA a ese nivel, el cual, para ser funcionalmente relevante, debe tener además, efectos biológicos2,19. Aunque la Ang II es el principal péptido bioactivo del SRA intracelular, también la renina o la prorrenina pueden tener efectos intracelulares, ya que existe un receptor intracelular para renina que se acopla a un sistema de transducción de señales en cascada y posee claros efectos celulares2,20.
En 1971 se observó que la Ang II inducía cambios en la estructura celular cuando se inyectaba en células de músculo liso y cardíaco. Más tarde se demostró que la Ang II intracelular tenía sitios de unión a la cromatina y era capaz de mediar cambios en la transcripción génica, inducir movilización de calcio intracelular en células vasculares de músculo liso y cardíacas, y estimular la proliferación de distintos tipos celulares2. El mecanismo de acción de la Ang II intracelular, involucra tanto a los depósitos de calcio intracelulares como a las rutas de señalización intracelular de fosfatidilinositol-3-cinasa (PI3K) y de MAPK (Mitogen-activated protein kinases), así como a receptores intracelulares de la Ang II2,19. El papel fisiológico y fisiopatológico del SRA intracelular queda aún por determinar. Se desconoce por el momento si el SRA intracelular es un sistema extendido en todos los tipos celulares o si está restringido a células, sistemas o tejidos específicos, o responde a ciertas condiciones fisiopatológicas. El hecho de que se hayan comprobado efectos de la Ang II intracelular en una amplia variedad de tipos celulares (como las células cardíacas, renales, hepáticas o vasculares) indica que se trata de un sistema muy relevante2.
SRA CARDÍACO
El AGT y la renina provienen tanto de la producción local como de la circulación. La ECA se expresa en cardiomiocitos y fibroblastos, al igual que el receptor de prorrenina (RPR), que se une a ésta y facilita la síntesis local de Ang II, la cual tiene lugar tanto en el espacio intersticial como a nivel intracelular. La síntesis extracelular de Ang II depende generalmente de la prorrenina y la ECA. En cardiomiocitos, la síntesis intracelular de Ang II puede ocurrir en el citoplasma, mediada por renina y quimasa, o en vesículas secretoras2.
La Ang II sintetizada en vesículas secretoras puede liberarse o relocalizarse en el interior de la célula. La vía de síntesis dependiente de quimasas es la predominante en condiciones de hiperglucemia, e incrementa de manera importante la concentración de Ang II intracelular, sin afectar a la concentración intersticial. La estimulación β adrenérgica activa la síntesis de Ang II, tanto en vesículas secretoras como en el espacio intersticial2. En fibroblastos, la síntesis de Ang II está catalizada por la renina y la ECA, y posiblemente su secreción dependa de la estimulación β adrenérgica y de la concentración de glucosa. La Ang II intracelular tiene muchos efectos biológicos, como el estímulo del crecimiento celular, la regulación de la expresión génica y la modulación de la producción de matriz extracelular2,21 (Figura 4).
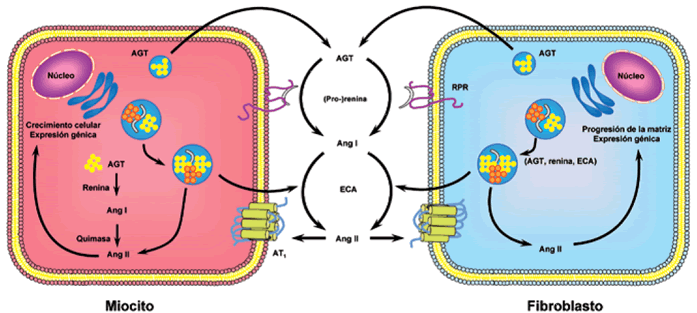
Figura 4. SRA intracelular cardíaco. Angiotensina (Ang), Angiotensinógeno (AGT), Enzima Conversora de Angiotensina (ECA), Receptor de renina-prorrenina (RPR). Tomada, sin modificar, con permiso de Rev Esp Cardiol 2011; 11(Supl D):13-1720.
Los efectos descritos anteriormente de la Ang II intracelular en la regulación de las concentraciones de calcio a ese nivel, en células vasculares de músculo liso, indican que la Ang II intracelular puede afectar el tono vascular. El SRA intracelular está elevado significativamente en diabéticos, y estudios recientes indican que es la resistencia celular a la acción de la insulina lo que predispone al incremento del tono vascular característico de la hipertensión en la diabetes. El nexo entre la resistencia a la insulina y el incremento del tono vascular podría ser la anormal homeostasis del calcio en células vasculares de músculo liso2.
Con relación al papel del SRA en el remodelado cardíaco, se sabe (mediante ensayos clínicos y estudios con animales de experimentación) que la inhibición farmacológica del SRA tiene un efecto beneficioso2,21. En cuanto al papel del SRA hístico se demostró que el incremento de la concentración cardíaca de Ang II sólo era relevante en condiciones en que también estaba elevada la concentración del receptor AT1, por lo que, teniendo en cuenta que la Ang II intracelular es un regulador positivo de la expresión de AT1 en cardiomiocitos y fibroblastos cardiacos2,21, la Ang II intracelular podría tener un papel fundamental en el remodelado2,22,23. Además, el SRA intracelular de los fibroblastos cardíacos se activa por concentraciones altas de glucosa y participa en la formación de la matriz extracelular en estas condiciones, por lo que podría tener un importante papel en la fisiopatología de la fibrosis miocárdica2,21.
Conclusiones
La activación crónica del SRA plasmático, hístico e intracelular se comporta como un sistema endocrino, paracrino o autocrino, en dependencia del lugar de acción, y produce la síntesis de Ang II que, al actuar sobre los receptores AT1 y AT2 en las células diana (la Ang IV actúa sobre AT4), incrementa las resistencias vasculares (sistémicas, pulmonares y coronarias) y la acción del sistema simpático, así como el estrés oxidativo, la liberación de mediadores vasoconstrictores y mitogénicos (aldosterona, catecolaminas, vasopresina, endotelina 1) y las citocinas; todo lo cual origina disfunción endotelial y efectos proliferativos (hipertrofia e hiperplasia celular, fibrosis) implicados en el remodelado cardiovascular y en las respuestas proinflamatorias y protrombóticas. Todas estas acciones conducen a un aumento permanente de la PA y la aparición de alteraciones en la estructura y función cardiovascular y renal, que se traducen en lesiones en los órganos diana (hipertrofia cardíaca, insuficiencia cardíaca y renal, ictus, nefropatías, arteriosclerosis) y aumentan la mortalidad por estas causas.
Referencias bibliográficas
Fyhrquist F, Saijonmaa O. Renin-angiotensin system revisited. J Intern Med. 2008;264(3):224-36.
Lago F, Lekuona I, González JR. El sistema renina-angiotensina intracelular. Papel de la inhibición directa de la renina. Rev Esp Cardiol. 2011;11(Supl D):13-7.
Coca A, Díez J. Inhibición directa de la renina: de la fisiología a la farmacología y las implicaciones clínicas. Introducción. Rev Esp Cardiol. 2011;11(Supl D):1-2.
Morales-Olivas FJ, Estañ L. La actividad de la renina plasmática. Papel de la inhibición directa de la renina. Rev Esp Cardiol. 2011;11(Supl D):3-7.
Tamargo J, Gómez R, Amorós I, Barana A, Caballero R, Delpón E, et al. Fisiopatología de la prorenina y la renina. Cincuenta años en busca de los inhibidores directos de la renina. Sus ventajas y sus limitaciones. Rev Esp Cardiol. 2009;9(Supl A):24-40.
Paul M, Poyan Mehr A, Kreutz R. Physiology of local renin-angiotensin systems. Physiol Rev. 2006;86(3):747-803.
Bader M, Ganten D. Update on tissue renin-angiotensin systems. J Mol Med (Berl). 2008;86(6):615-21.
Burrell LM, Risvanis J, Kubota E, Dean RG, MacDonald PS, Lu S, et al. Myocardial infarction increases ACE2 expression in rat and humans. Eur Heart J. 2005;26(4):369-75.
Keidar S, Kaplan M, Gamliel A. ACE2 of the heart: from angiotensin I to angiotensin (1-7). Cardiovasc Res. 2007;73(3):463-9.
Thone C, Steckelings UM, Unger T. Angiotensin receptor blockers and cerebral protection in stroke. J Hypertens Suppl. 2006;24(1):S115-21.
Achard V, Boullu S, Desbriere R, Nguyen G, Grino M. Renin receptor expression in human adipose tissue. Am J Physiol Regul Integr Comp Physiol. 2007;292(1):R274-82.
Kondoh G, Tojo H, Nakatani Y, Komazawa N, Murata C, Yamagata K, et al. Angiotensin-converting enzyme is a GPI-anchored protein releasing factor crucial for fertilization. Nat Med. 2005;11(2):160-6.
Takai S, Jin D, Muramatsu M, Miyazaki M. Chymase as a novel target for the prevention of vascular diseases. Trends Pharmacol Sci. 2004;25(10):518-22.
Zini S, Fournie MC, Chauvel E, Roques BP, Corvol P, Llorens-Cortes C. Identification of metabolic pathways of brain angiotensin II and III using specific aminopeptidase inhibitors: predominant role of angiotensin III in the control of vasopressin release. Proc Natl Acad Sci USA. 1996;93(21):11968-73.
Chai SY, Fernando R, Peck G, Ye SY, Mendelsohn FA, Jenkins TA, et al. The angiotensin IV. AT4 receptor. Cell Mol Life Sci. 2004;61(21):2728-37.
Ruiz M, Esteban V, Egido J. The regulation of the inflammatory response through nuclear factor-kappab pathway by angiotensin IV extends the role of the renin angiotensin system in cardiovascular diseases. Trends Cardiovasc Med. 2007;17(1):19-25.
Ferrario CM. Angiotensin-converting enzyme 2 and angiotensin 1-7: an evolving story in cardiovascular regulation. Hypertension. 2006;47(3):515-21.
Santos RA, Ferreira AJ. Angiotensin (1-7) and the renin-angiotensin system. Curr Opin Nephrol Hypertens. 2007;16(2):122-8.
Kumar R, Singh VP, Baker KM. The intracellular renin-angiotensin system: a new paradigm. Trends Endocrinol Metab. 2007;18(5):208-14.
Schefe JH, Menk M, Reinemund J, Effertz K, Hobbs RM, Pandolfi PP, et al. A novel signal transduction cascade involving physical interaction of the renin/prorenin receptor with the transcription factor promyelocytic zinc finger protein. Circ Res. 2006;99(12):1355-66.
Kumar R, Singh VP, Baker KM. The intracellular renin-angiotensin system in the heart. Curr Hypertens Rep. 2009;11(2):104-10.
Singh VP, Baker KM, Kumar R: Activation of the intracellular reninangiotensin system in cardiac fibroblasts by high glucose: role in extracellular matrix production. Am J Physiol Heart Circ Physiol. 2008;294:H1675-84.
Kumar R, Singh VP, Baker KM. The intracellular renin-angiotensin system: implications in cardiovascular remodelling. Curr Opin Nephrol Hypertens. 2008;17(2):168-73.
Recibido: 13 de abril de 2012
Aceptado para su publicación: 25 de mayo de 2012






















