CorSalud 2012 Oct-Dic;4(4):246-253
ARTÍCULO ORIGINAL
CONDUCCIÓN ANESTÉSICA DE LA CIRUGÍA CARDÍACA MÍNIMAMENTE INVASIVA*. ESTUDIO PRELIMINAR
MSc.Dr. Antonio de Arazoza Hernández1a, Dr. Fausto Leonel Rodríguez Salgueiro2b, Dra. Elizabeth Rodríguez Rosales3c, Dr. Amaury Fernández Molina4b, Dr. Miguel Ángel Carrasco Molina5a y MSc.Dr. Osvaldo Valdés Dupeirón6a
______________
Especialista de I Grado de Medicina General Integral y de II Grado en Anestesiología y Reanimación. Máster en Urgencias y Emergencias Médicas. Diplomado en Anestesiología Cardiovascular. Profesor Asistente.
Especialista de Segundo Grado en Anestesiología y Reanimación. Diplomado en Anestesiología Cardiovascular. Profesor e Investigador Auxiliar.
Especialista de I Grado de Medicina General Integral y en Cardiología.
Especialista de I Grado en Anestesiología y Reanimación. Diplomado en Anestesiología Cardiovascular.
Especialista de I Grado de Cirugía General y en Cirugía Cardiovascular.
Especialista de I Grado en Cirugía Cardiovascular. Máster en Urgencias y Emergencias Médicas.
Cardiocentro del Centro de Investigaciones Médico−Quirúrgicas (CIMEQ). La Habana, Cuba.
Instituto de Cardiología y Cirugía Cardiovascular. La Habana, Cuba.
Hospital Clínico−Quirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
Correspondencia: A de Arazoza Hernández. CIMEQ. Calle 216 y 11B. Rpto Siboney, Playa. CP 12100, La Habana, Cuba.
Correo electrónico: dearazoza@infomed.sld.cu
Resumen
Introducción y objetivos: La cirugía cardíaca mínimamente invasiva ofrece muchas ventajas para los pacientes de alto riesgo; pero las dificultades de estos procedimientos no solo dependen de la técnica quirúrgica, sino de la conducta anestésica, lo que constituye un reto para el anestesiólogo cardiovascular. El objetivo de esta investigación fue demostrar la factibilidad de la conducta anestésica diseñada en el Cardiocentro CIMEQ para las técnicas quirúrgicas video−asistidas, y comparar el comportamiento de algunas variables en dos grupos de estudio. Método: Se realizó un estudio retrospectivo de los pacientes operados de corazón en los últimos tres años en el Cardiocentro CIMEQ. Se dividieron en dos grupos, según la técnica quirúrgica empleada. Los pacientes operados mediante cirugía cardíaca convencional (esternotomía media) se incluyeron en el grupo 1, y los de cirugía cardíaca mínimamente invasiva se incluyeron en el grupo 2, en los que se utilizó una técnica anestésica diseñada al efecto. Resultados: El tiempo anestésico, quirúrgico, de circulación extracorpórea y de pinzamiento aórtico, así como el número de unidades de glóbulos rojos transfundidas por paciente fue significativamente menor en el grupo de cirugía cardíaca video−asistida. De forma similar se comportó la estadía en la Unidad de Cuidados Intensivos y en la Sala de Cardiología; y de igual manera, el inicio de la deambulación y las complicaciones posquirúrgicas. Conclusiones: La conducción anestésica con este protocolo de trabajo es segura y factible. Los pacientes operados por esta técnica tienen muy buena recuperación, con pocas complicaciones postoperatorias, y menor estadía hospitalaria; además, es una buena opción para los pacientes de alto riesgo necesitados de cirugía, que no cumplen los criterios para el tratamiento percutáneo.
Palabras clave: Anestesiología, Anestesia de conducción, Cirugía cardíaca asistida por video, Procedimientos quirúrgicos mínimamente invasivos
Abstract
Introduction and Objectives: Minimally invasive cardiac surgery offers many advantages for high−risk patients, but the difficulties of these procedures do not only depend on the surgical technique, but on the anesthetic management, which is a challenge for the cardiovascular anesthesiologist. The objective of this research was to demonstrate the feasibility of the anesthetic management for video−assisted surgical techniques designed at Cardiocentro CIMEQ, and to compare the behavior of some variables in two study groups. Method: A retrospective study of patients who underwent heart surgery in the past three years at Cardiocentro CIMEQ. They were divided into two groups according to the surgical technique used. Patients operated using conventional cardiac surgery (median sternotomy) were included in group 1, and those with minimally invasive cardiac surgery were included in group 2, to whom an anesthetic technique designed for this purpose was used. Results: The anesthetic, surgical, extracorporeal circulation and aortic clamping time and the number of units of transfused red blood cells per patient was significantly lower in the video−assisted cardiac surgery group. The stay in the Intensive Care Unit and in the cardiology department was similar, and so was the onset of walking and postoperative complications. Conclusions: The anesthesia management with this work protocol is safe and feasible. Patients operated with this technique have a very good recovery, few postoperative complications, and shorter hospital stays. In addition, it is a good choice for high−risk patients in need of surgery, which do not meet the criteria for percutaneous treatment.
Key words: Anesthesiology; Anesthesia, conduction; Video-assisted cardiac surgery; Minimally invasive surgical procedures
Introducción
Clásicamente la cirugía cardíaca se realiza mediante esternotomía media, con canulación de los grandes vasos del tórax, aunque en los últimos 16 años se han desarrollado nuevas técnicas de cirugía cardiovascular por mínimo acceso, conocidas con las siglas en inglés MICS Minimally Invasive Cardiac Surgery)1. Aunque no existe un consenso formal en cuanto a las técnicas que agrupa, se aceptan entre ellas todas aquellas que se realicen a través de incisiones diferentes a la esternotomía media total, como son: esternotomías parciales altas o bajas, minitoracotomías laterales, acceso subxifoideo, acceso subdiafragmático y el acceso endoscópico total o PACS (Port-Access Cardiac Surgery)2-4.
La conducción anestésica de este tipo de cirugía es un reto para el anestesiólogo por incluir elementos propios como los relacionados con la fisiología y las complicaciones de la posición, el uso de fármacos de muy corta duración, la colocación de una sonda endotraqueal de doble luz, que permita colapsar uno de los pulmones del enfermo; todo esto en un paciente que presenta una cardiopatía subyacente, una predisposición a la aparición de arritmias perioperatorias y la frecuente asociación de isquemia miocárdica, dilatación de cavidades cardíacas, baja fracción de eyección del ventrículo izquierdo, o algún grado de afectación valvular.
Se requiere entonces de una estrategia particular de ventilación, un apoyo inotrópico y vasoactivo, o ambos; y una selección cuidadosa de los agentes anestésicos para evitar la desaturación de oxígeno de la hemoglobina y el consecuente deterioro hemodinámico5,6.
Sin embargo, las dificultades para realizar e implementar los procedimientos video−asistidos no se encuentran en la técnica quirúrgica, sino fundamentalmente en la anestésica7,8.
Hace tres años se comenzó a diseñar un protocolo de conducción anestésica en el Cardiocentro del Centro de Investigaciones Médico−Quirúrgicas (CIMEQ), que permitió realizar primero, técnicas "sencillas" como la colocación video−asistida de electrodos epicárdicos y ventanas pericárdicas transtorácicas, luego revascularizaciones miocárdicas5 y más tarde, con la adición de la circulación extracorpórea, sustituciones valvulares video−asistidas, ambas por primera vez en Cuba6.
El objetivo de esta investigación fue demostrar la factibilidad de la conducta anestésica diseñada en el Cardiocentro CIMEQ para las técnicas quirúrgicas video−asistidas.
Método
Se realizó un estudio retrospectivo de los casos operados de cirugía cardíaca en el Cardiocentro CIMEQ, en el período de octubre de 2008 a octubre de 2011 (tres años), que cumplieran con los siguientes criterios:
Criterios de inclusión
Mayores de 18 años, de ambos sexos, programados para cirugía cardíaca electiva de revascularización miocárdica, sustitución valvular, ventana pericárdica o colocación de electrodos epicárdicos, en el período de tiempo seleccionado.
Criterios de exclusión
1. Otros tipos de operaciones realizados por cirugía cardíaca convencional y que no tienen forma de realizarse mediante procedimientos video-asistidos (cirugías vasculares, de la aorta torácica y casos mixtos).
2. Safenectomías video-asistidas que, aunque se pudiesen comparar con las safenectomías convencionales, no son procedimientos que se realicen directamente sobre el corazón y no requieren de una conducción anestésica específica.
Estos pacientes se dividieron en dos grupos, según la técnica quirúrgica empleada. El grupo 1 estuvo conformado por los pacientes operados mediante cirugía cardíaca convencional, el grupo 2, por aquellos operados mediante cirugía cardíaca video-asistida.
Los pacientes del grupo 1 fueron conducidos, según los protocolos establecidos al efecto en el Cardiocentro CIMEQ que no difieren, en lo esencial, de los protocolos de actuación del resto de los Cardiocentros del país, es decir, se utiliza sonda orotraqueal convencional, los abordajes venosos profundos por el lado derecho y ventilación mecánica convencional. Los pacientes del grupo 2 fueron tratados con la técnica de anestesia general diseñada en este Cardiocentro, como se describe a continuación:
Técnica anestésica
A los pacientes se les cateterizó una vena del antebrazo izquierdo y la arteria radial del mismo lado en la unidad quirúrgica. Para la inducción se administró midazolam (0,2 mg/kg), fentanil (10 mcg/kg) y atracurio (0,6 mg/kg). Se colocó una sonda endotraqueal de doble luz Robertshaw (izquierdo en los valvulares y derecho en los coronarios), la cual se cambió por una convencional al finalizar la intervención quirúrgica. Se realizaron dos abordajes venosos profundos, uno en la vena yugular interna izquierda, para la ubicación de un introductor 8F con catéter de tres vías y el otro, en la vena yugular interna derecha, donde el cirujano colocó posteriormente una cánula percutánea de vena cava superior para el drenaje venoso asistido al vacío, a la máquina de circulación extracorpórea. La monitorización utilizada fue la establecida para la cirugía cardíaca convencional.
Para la profilaxis antibiótica se administró cefazolina 1 gramo endovenoso (EV) cada 8 horas durante 48 horas, y para prevenir la fibrinólisis, ácido tranexámico (10 mg/kg) EV, previo al estímulo quirúrgico, dosis que se repitió después de finalizar la circulación extracorpórea (antes de administrar sulfato de protamina).
Previo a la anticoagulación del paciente se colocó una sonda de ecocardiografía transesofágica, con el objetivo de verificar la posición de todas las cánulas y del Endoclamp® aórtico, así como para comprobar la eliminación del aire de las cavidades izquierdas al cierre de estas, y antes de retirar el Endoclamp®.
Para lograr la anticoagulación y para su reversión, se utilizaron: heparina a 4 mg/kg para mantener el tiempo de coagulación activado (TCA) superior a 500 segundos, y sulfato de protamina, de 1,2−1,5 veces la dosis de heparina administrada.
La estrategia ventilatoria utilizada durante el colapso pulmonar derecho, para evitar la desaturación de oxígeno de la hemoglobina, fue la misma descrita para la cirugía coronaria en esta misma revista5, con la particularidad de que no es necesario realizar períodos de ventilación bipulmonar de cinco minutos cada 55 minutos de colapso, para evitar atelectasias y acumulación de secreciones, ya que el tiempo de colapso pulmonar se reduce mucho (máximo 20 minutos) con la sustitución de la ventilación pulmonar por el uso de la máquina de circulación extracorpórea. Los pacientes se ventilaron en la modalidad de volumen control con ajuste de la frecuencia respiratoria para mantener la presión parcial de dióxido de carbono (PCO2) alrededor de 40 mmHg, y las presiones intrapulmonares, menores de 35 mmHg.
Durante el período intraoperatorio se mantuvo una infusión continua de fentanil (0,05 μg/kg/min) y se administraron dosis suplementarias de atracurio (0,05 mg/kg), midazolam (0,07mg/kg) e isoflurano inhalado, como complemento de la anestesia general balanceada. Se procuró la comodidad del paciente en la posición de decúbito lateral y durante los cambios de posición. Todas las infusiones se colocaron en la misma línea venosa profunda y se profundizó la analgesia antes de las maniobras de máximo dolor (apertura de la piel, costotomía, y apertura del pericardio). Durante la circulación extracorpórea se disminuyó la temperatura a 34° C y antes de terminarla, se recalentó hasta 36° C.
Se canuló la arteria femoral derecha para colocar el Endoclamp® aórtico, que es una sonda con globo que se introduce hasta la raíz de la aorta (unión sinotubular), controlado por ecocardiografía transesofágica y una vez allí, se infla para ocluir esta arteria. A través de esta sonda se instiló la solución de cardioplejía para detener el corazón. Se aspiró por una sonda (vent) en aurícula izquierda a través de la válvula protésica. Se realizó la canulación fémoro−femoral izquierda más el drenaje venoso de la yugular interna derecha para el empleo de la circulación extracorpórea. Se colocó una prótesis valvular mitral por minitoracotomía lateral derecha de 6 cm.
El seguimiento hemogasométrico y de la glucemia se efectuó durante todo el período perioperatorio, y cualquier alteración de alguno de sus valores, se corrigió de inmediato. El nivel de heparinización fue guiado por los TCA que se realizaron cada 1 hora, hasta su reversión. Antes de finalizar la intervención quirúrgica se colocó un drenaje y sello de agua, y se sustituyó el tubo de doble luz por un tubo convencional.
Análisis estadístico
Para el análisis de los datos se utilizó el paquete estadístico SPS®® para Windows XP versión 15.0, y se aplicó el método estadístico de Chi cuadrado (Pearson) para determinar la correlación entre variables y su significación estadística.
Resultados
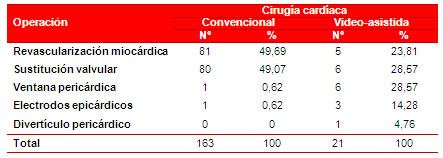
La distribución de los pacientes intervenidos se releja en la tabla 1. Predominaron los pacientes con cirugía convencional (163, que representa el 88,6 % del total de pacientes operados durante los tres años analizados). En el grupo de la cirugía cardíaca video−asistida se encuentran 21 pacientes, de ellos, 6 (28,57 %) se beneficiaron con una sustitución valvular e igual número con la realización de una ventana pericárdica. Al 23,81 % (5 pacientes) se les realizó revascularización miocárdica y, en menor medida, implantación de electrodos epicárdicos (14,28 %) y solución de divertículo pericárdico (4,76 %).
Tabla 1. Distribución de los pacientes, según el tipo de operación realizada
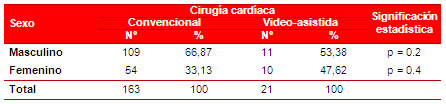
Como se observa en las tablas 2 y 3, no hubo diferencias significativas en cuanto a la distribución por edad y sexo entre los grupos estudiados. No obstante, en el grupo 1 predominaron los hombres (66,87 %) y en el grupo 2 la distribución del género fue similar (53,38 vs. 47,62 %).
Tabla 2. Correlación estadística de la edad en ambos grupos.
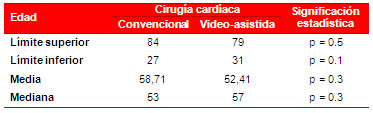
Tabla 3. Distribución de los pacientes, según sexo y tipo de cirugía
La fracción de eyección del ventrículo izquierdo (FEVI) fue muy inferior en el grupo de cirugía cardíaca video-asistida (Tabla 4), con límites superior (p=0.10) e inferior (p=0.01) de 57 y 13 %, a diferencia del grupo 1 (66 y 32 %). La media de este último (53,33) fue superior al 39,76 % del grupo 2, con una diferencia estadísticamente significativa (p=0.04).
Tabla 4. Correlación estadística de la FEVI en ambos grupos.

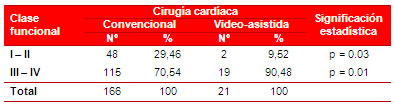
De forma similar sucedió con la clasificación funcional (Tabla 5), según la Asociación del Corazón de Nueva York (NYHA, por sus siglas en inglés), que fue mayor, es decir, más comprometida, en los casos que se realizaron por la técnica video−asistida, donde alcanzó una asociación estadística significativa (29,46 vs. 9,52 %; p=0,03) en los pacientes con clase funcional I−II, y muy significativa (70,54 vs. 90,48 %; p=0,01) en los de clase funcional III−IV.
Tabla 5. Distribución de pacientes por grupos, según su clase funcional por la clasificación de la NYHA.
Los tiempos promedio anestésico (6,9 vs. 6,0 horas) y quirúrgico (6,1 vs. 5,2 horas) de la cirugía cardíaca video−asistida (Tabla 6), fueron significativamente inferiores a los tiempos promedio de la cirugía cardíaca convencional evaluada en el mismo período de tiempo (p=0.04 en ambos casos).
Tabla 6. Tiempos del transoperatorio y necesidad de transfusiones.
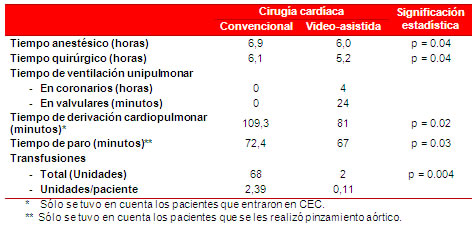
El tiempo promedio de ventilación unipulmonar fue de 4 horas en la cirugía coronaria y de 24 minutos en la valvular. Los tiempos de (bypass) derivación cardiopulmonar (109,3 vs. 81 minutos) y de paro anóxico (72,4 vs. 67 minutos) fueros inferiores, con una diferencia estadística significativa de p=0.02 y p=0.03, respectivamente.
Otro resultado importante fue el hecho de que las transfusiones de sangre fueron menores en el grupo 2 (68 vs. 2 unidades), con una diferencia estadística muy significativa. Se transfundieron 0,11 ud/paciente en este grupo y 2,39 en el grupo 1.
Los tiempos de duración de algunas variables postoperatorias se muestran en la tabla 7. Todas mostraron una diferencia estadística significativa. En el grupo 2 los pacientes fueron extubados en un tiempo promedio de 3,17 horas (p=0.03), la estadía en terapia intensiva fue de 20 horas (p=0.02), en la sala de Cardiología de 7 días (p=0.04), y comenzaron a caminar a las 24 horas del postoperatorio (p=0.02).





