CorSalud 2014 Oct-Dic;6(4):321-333
ARTÍCULO DE REVISIÓN
BIOMARCADORES DE DAÑO MIOCÁRDICO
Dr. Suilbert Rodríguez Blancoa, Dr. Cs. Javier Almeida Gómezb y Dr. Jeddú Cruz Hernándezc
______________
Policlínico "Nguyen Van Troi". Centro Habana. La Habana, Cuba.
Hospital "Hermanos Ameijeiras". La Habana, Cuba.
Instituto de Endocrinología. La Habana, Cuba.
Correspondencia: S Rodríguez Blanco. Calle 17 N° 1470 e/ 28 y 30. Vedado. La Habana, Cuba. Correo electrónico: suilbert@infomed.sld.cu
Resumen
El dolor torácico agudo es un síntoma frecuente en los servicios de urgencia. Las determinaciones seriadas de biomarcadores cardíacos en su valoración, ayuda al diagnóstico, a estratificar el riesgo, y tiene implicaciones pronósticas y terapéuticas. Se propone una revisión sobre los biomarcadores de daño miocárdico: troponinas cardíacas, creatinquinasa fracción MB, péptidos natriuréticos y otros nuevos biomarcadores cardíacos; así como su comportamiento en el síndrome coronario agudo y otras cardiopatías. Son una herramienta esencial para la valoración de pacientes con dolor torácico, como complemento de la clínica, fundamentalmente las troponinas cardíacas, por su alta sensibilidad y el valor predictivo negativo.
Palabras clave: Dolor torácico, Biomarcadores cardíacos, Diagnóstico, Síndrome coronario agudo
Biomarkers of myocardial injury
Abstract
Acute chest pain is a frequent symptom in emergency services. The serial measurements of cardiac biomarkers, in their assessment, aid diagnosis, risk stratification, and have prognostic and therapeutic implications. A review of biomarkers of myocardial injury is proposed: cardiac troponins, creatine kinase MB fraction, natriuretic peptides and other novel cardiac biomarkers; as well as their behavior in acute coronary syndrome and other heart diseases. They are an essential tool for the evaluation of patients with chest pain, in addition to the clinical method, mainly cardiac troponins because of its high sensitivity and negative predictive value.
Key words: Chest pain, Cardiac biomarkers, Diagnosis, Acute coronary syndrome
Introducción
El dolor torácico agudo es uno de los síntomas más frecuentes encontrados en los servicios de urgencia, la valoración precoz facilita la implementación inmediata de algoritmos diagnósticos y terapéuticos, decisivos para un pronóstico favorable; por el contrario una valoración prolongada en el tiempo, del dolor torácico en urgencias, no solo empeora el pronóstico, sino que aumenta el trabajo y el costo económico. De esta manera, a los pacientes con dolor torácico, sospechoso de isquemia miocárdica, se les deben realizar (además de la valoración clínica y electrocardiográfica) determinaciones seriadas de biomarcadores cardíacos que ayudan a estratificar el riesgo y definir su diagnóstico1.
Estos biomarcadores son proteínas, componentes estructurales de las células que se liberan a la circulación cuando ocurre una lesión miocárdica2. Son parámetros biológicos que al cuantificarlos indican un proceso normal, patológico, o aportan una idea de la posible respuesta terapéutica del paciente. Por lo tanto, desempeñan un papel fundamental en el diagnóstico, la estratificación de riesgo y en el tratamiento de los pacientes con dolor torácico y sospecha de síndrome coronario agudo (SCA), y cuadros de exacerbación de insuficiencia cardíaca (IC)2.
Estos biomarcadores constituyen el centro en la nueva definición de infarto de miocardio (IM), formulada por el Colegio Americano de Cardiología (ACC) y la Sociedad Europea de Cardiología (ESC). La lesión miocárdica se detecta mediante biomarcadores sensibles y específicos, cuando estos aumentan sus concentraciones3. La evidencia histológica de la lesión miocárdica con necrosis también puede detectarse en condiciones clínicas asociadas a lesión miocárdica no isquémica, como ocurre en la IC, la insuficiencia renal, la miocarditis, las arritmias, la embolia pulmonar o los procedimientos quirúrgicos coronarios o percutáneos sin incidentes. No se debe calificar estos casos como IM o una complicación de los procedimientos, sino como una lesión miocárdica3.
Las investigaciones en este ámbito han aportado una larga lista de nuevos pacientes posiblemente necesitados de la determinación de marcadores de daño miocárdico, pero no todos cumplen los criterios de tiempo y aplicación a la clínica. El acercamiento y dominio en el avance de estas nuevas pruebas incruentas, es necesario para obtener mejores resultados en la atención a pacientes con enfermedades cardiovasculares4.
Troponinas cardíacas (TnC)
Troponinas cardíacas convencionales
Las TnC I y T son componentes del aparato contráctil de las células miocárdicas que se encuentran casi exclusivamente en el corazón. Aunque las elevaciones de estos biomarcadores en la sangre reflejan una lesión que resulta en necrosis de las células miocárdicas, no indican el mecanismo subyacente5. Se han propuesto varias posibilidades para liberar las proteínas estructurales del miocardio, incluida la recuperación normal de las células miocárdicas, apoptosis, liberación celular de productos de degradación de la troponina, aumento de la permeabilidad de la pared celular, formación y liberación de ampollas membranosas y necrosis miocítica4,6.
Durante las últimas 2 décadas, las TnC han surgido como el biomarcador preferido para la determinación incruenta de lesión miocárdica7. La definición actual de IM agudo en un contexto clínico, que indique o sea compatible con isquemia miocárdica, requiere el hallazgo de un patrón de ascenso o descenso en los valores de algún biomarcador de daño o necrosis miocárdica, preferiblemente, por sus altas sensibilidad y especificidad, la troponina; al menos uno de los valores de troponina debe estar situado por encima del percentil 99 del límite superior de referencia (LSR), según el método utilizado en cada laboratorio. Se deben extraer muestras de sangre en la primera evaluación para medir la TnC y repetirlas a las 3-6 horas. Se necesitan muestras posteriores si ocurren más episodios isquémicos o cuando el tiempo de inicio de los síntomas no sea preciso.
Sin embargo, numerosas situaciones agudas y crónicas, distintas del SCA, producen elevaciones pequeñas de los niveles de TnC, como ocurre en la miopericarditis, las lesiones tóxicas, la sobrecarga cardíaca excesiva, entre otras8-10. Dentro de las crónicas se pueden señalar a la enfermedad renal crónica y la IC, con elevaciones marcadas de las TnC, pero sin cambios agudos en sus valores3,11-14.
Es importante señalar, que en pacientes con altas probabilidades de infarto agudo de miocardio (IAM), que acuden mucho tiempo después del inicio de los síntomas, no es necesario un patrón de ascenso o descenso en los niveles de TnC para el diagnóstico, ya que se pueden encontrar cerca del umbral de la curva tiempo-concentración de TnC o de declive lento de dicha curva11.
En un estudio observacional de pacientes, con clínica de dolor torácico compatible con SCA, a los que se les realizó un protocolo de diagnóstico rápido para identificar grupos de bajo riesgo, se demostró su utilidad al combinar los hallazgos en el electrocardiograma (ECG), con determinaciones de TnC-T al ingreso y a las 2 horas, y el cálculo del índice TIMI15. Se definió bajo riesgo cuando el ECG y la TnC-T fueron negativas, y el índice TIMI fue 0. Este protocolo posee alta sensibilidad y un elevado poder predictivo negativo.
En relación con el intervencionismo coronario percutáneo (ICP), el marcador más sensible en la detección de daño miocardio es el incremento de TnC I ó T16. El IM relacionado con la ICP se define por la elevación de los títulos de TnC > 5 × percentil 99 del LSR en pacientes con valores basales normales (≤ 99 percentil del LSR), o un aumento de TnC > 20 % si los valores basales eran elevados y estables, o descienden3.
La implicación pronóstica de una elevación de TnC después de un ICP no está totalmente clara. Los estudios realizados por Gómez-Hospital, et al.16, Fuchs et al.17 y Cavallini et al.18, mostraron que cualquier incremento de TnC detectados después de ICP no tienen implicaciones pronósticas en el seguimiento a medio o largo plazo, pues se relacionan con un daño miocárdico mínimo. Por su parte, Fuchs et al.17 y Nallamothu et al.19, concluyen que un aumento de estos biomarcadores, después de ICP, incrementa el riesgo de complicaciones a corto plazo (intrahospitalarias); aunque Nallamothu et al.19 lo considera cuando el valor de TnC es de más de 8 veces su punto de corte.
La diferencia del estudio publicado por Gómez-Hospital et al.16 es que añade el valor de la CK-MB, lo que permite diferenciar el daño miocárdico mínimo (sin alteración del pronóstico) de la mionecrosis (daño miocárdico mayor). Este estudio concluye que en pacientes con enfermedad coronaria estable o inestable con marcadores de daño miocárdico negativos antes del procedimiento, un incremento del valor de troponina sin un incremento de CK-MB durante el ICP no está relacionado con episodios cardíacos adversos durante el seguimiento a largo plazo. Por el contrario, el incremento concomitante del valor de troponina I y de CK-MB se asocia a un aumento de la mortalidad durante el seguimiento. Este hecho indicaría la necesidad de determinar la CK-MB tras todo ICP para poder valorar la influencia en el pronóstico del daño miocárdico producido por este procedimiento.
Por otra parte, Prasad et al.20 demostraron la menor sensibilidad de la TnC-I para la detección de daño miocárdico tras ICP, lo que significa que la TnC-T detecta mayor grado de daño.
El consolidado papel de las TnC en el diagnóstico del IAM queda eclipsado en el espectro de la IC por su elevación persistente en esta enfermedad. Ante un aumento brusco de TnC durante un episodio de IC aguda, se debe descartar un IAM tipo 1 (rotura-ulceración de la placa), aunque ha sido descrita la frecuente presencia de concentraciones elevadas de TnC en la IC aguda y crónica sin relación con este tipo de IAM21.
La liberación de troponinas al torrente circulatorio es común en pacientes diabéticos o con aterosclerosis extensa por: disfunción endotelial, isquemia subendocárdica (agravada por anemia o hipotensión), presiones de llenado ventricular elevadas y rigidez del miocardio. Dado que la clínica típica sugestiva de isquemia no siempre está presente, será adecuado realizar mediciones seriadas para situar los valores en el contexto de su elevación21.
Shave et al.22, en una revisión sobre la elevación de TnC en el ejercicio físico, concluyen que es probablemente debida a un fenómeno benigno relacionado con el goteo de TnC por la membrana del miocito en lugar de su necrosis. Esta conclusión debe ser analizada con cautela, dada la falta de seguimiento adecuado a largo plazo en los atletas de alto rendimiento23. Existe evidencia creciente que en algunos de estos, después de varios años de práctica, pueden aparecer anormalidades en el ventrículo derecho, agrandamiento, disfunción y potenciación de arritmias letales23,24. Estos deportistas son clínica y genéticamente distintos a los pacientes con displasia arritmogénica del ventrículo derecho y cardiomiopatías familiares; una hipótesis planteada es la tensión que se crea en dicho ventrículo, lo que en ocasiones lleva a necrosis miocárdicas que, aunque son pequeñas, justifican la elevación de TnC después del ejercicio25; el efecto acumulativo de estos episodios de necrosis, forman una fibrosis que resulta en disfunción del ventrículo derecho y potencian arritmias letales23,25.
Las causas extracardíacas de liberación de TnC al torrente sanguíneo son, entre otras: distrofias musculares, procesos inflamatorios sistémicos o autoinmunes, y la insuficiencia renal; la relación existente entre esta última con la elevación de estos marcadores y el daño del miocardio es producido por la propia afectación de la enfermedad a nivel sistémico, y no por la disminución del filtrado glomerular21.
Troponinas cardíacas ultrasensibles
La industria ha ido mejorando la capacidad de detectar mínimas cantidades de TnC. Hoy se dispone de una generación de métodos de medición de TnC de alta sensibilidad o ultrasensibles (TnC-US), que están desplazando a los convencionales26, con los que se ha mejorado la sensibilidad diagnóstica, especialmente en las primeras horas tras el comienzo de los síntomas27.
Si han transcurrido menos de 6 horas desde el episodio de dolor, se aconseja una segunda determinación de TnC-US a las 3 horas de la llegada del paciente a urgencias; mientras que si han pasado más de 6 horas desde el cuadro de dolor, una sola determinación de TnC-US negativa es suficiente para descartar necrosis miocárdica. La TnC-US tiene un valor predictivo independiente respecto al pronóstico y la mortalidad a corto y medio plazos28,29.
La TnC-US también tiene aspectos controvertidos. El aumento en la sensibilidad del método se produce a expensas de menos especificidad y valor predictivo positivo, lo que aumenta el número de falsos positivos30-32. De los pacientes que acuden a urgencias con dolor torácico y muestran aumento de TnC-US en las primeras horas del inicio de los síntomas, solo un 50-80 % tiene un IAM como diagnóstico final27. De ahí la necesidad de considerar siempre el valor de la TnC-US dentro de un contexto clínico determinado y siempre tras la exclusión de otras causas graves que hayan podido inducir un aumento en las concentraciones de este marcador.
Con el advenimiento de la TnC-US, las causas de elevación de TnC no relacionadas con SCA, se han vuelto más comunes en pacientes que acuden a urgencias con dolor precordial33. En el caso de la IC crónica, un gran número de pacientes presentan valores de TnC elevados de forma crónica, dato que aumenta con el uso de TnC-US. Aquellos con valores elevados o curvas en marcado ascenso, o ambos, presentarán peor evolución que los que mantienen valores estables21.
Un estudio publicado en la revista Journal of The American Heart Association34, comparó la capacidad diagnóstica de las TnC convencionales con las TnC-US en una población que acude a urgencias con sospecha de IAM, y se utilizó el percentil 99 como punto de corte. La sensibilidad y especificidad fue de 89 y 80 % para la primera, y de 91 y 74 % para la TnC-US. Se concluye que en una población no seleccionada de pacientes que acuden a urgencias, la rentabilidad diagnóstica de ambas troponinas no difiere. Con la TnC-US se detectan más enfermedades cardíacas; sin embargo, no predice de forma independiente ni los reingresos en urgencias, ni la mortalidad por cualquier causa. Estos resultados pueden parecer contradictorios a otros estudios que analizan la eficacia diagnóstica de la TnC-US; no obstante, estos han sido realizados en poblaciones seleccionadas de pacientes con dolor torácico, y elevada prevalencia de la enfermedad.
El estudio PITAGORAS35 es una investigación multicéntrica española que evaluó la troponina T ultrasensible (TnT-US) en pacientes con dolor torácico y troponina convencional normal. Sus resultados principales indican que la historia clínica y el ECG son los instrumentos fundamentales para el diagnóstico de SCA en estos pacientes, aunque la ausencia de cantidades detectables de TnT-US, muestra un elevado valor predictivo negativo (VPN) que podría ser de utilidad clínica. Además, en pacientes que acuden al servicio de urgencias por dolor torácico sin daño o con mínimo daño miocárdico no detectable con la troponina habitual, la TnT-US aporta información sobre el diagnóstico y el pronóstico; por consiguiente, puede ayudar en la toma de decisiones.
En resumen, la TnT-US ha mejorado el diagnóstico del SCA en pacientes que se presentan con dolor torácico y TnC convencional normal, preferiblemente en las primeras horas36.
CK-MB
La tercera definición de infarto de miocardio3 indica que en caso de que no haya una prueba de TnC disponible, la mejor alternativa es la CK-MB, medida mediante la prueba de masa. Al igual que con la troponina, un valor de CK-MB elevado > 99 percentil del LSR, se designa como el umbral de decisión para el diagnóstico de IM, y se deben utilizar valores específicos por sexo37,38.
En el caso de IAM asociado a ICP, se puede establecer con un aumento de la CK y su isoforma CK-MB, 3 veces por encima del valor normal, incremento que se asocia a reducción de la supervivencia durante el seguimiento16. En el estudio de Gómez-Hospital et al.16, el aumento de la CK-MB se relacionó con mionecrosis y esta a su vez, con alteraciones importantes de la circulación coronaria en un territorio concreto, como el fenómeno de no-reflujo o la oclusión de la rama lateral, lo cual causa un daño estructural en el miocardio. En este estudio se concluye que en un grupo de pacientes con enfermedad coronaria estable o inestable con marcadores de daño miocárdico negativos antes del procedimiento, un incremento del valor de troponina sin un incremento de CK-MB durante el ICP no está relacionado con episodios cardíacos adversos durante el seguimiento a largo plazo. Por el contrario, el incremento concomitante del valor de troponina I y de CK-MB está asociado con un incremento de mortalidad durante el seguimiento. Este hecho indicaría la necesidad de determinar la CK-MB tras todo ICP para poder valorar la influencia en el pronóstico del daño miocárdico producido por el ICP.
Péptidos natriuréticos (PN)
Los péptidos natriuréticos, denominados hormonas cardíacas, también son utilizados como marcadores de daño miocárdico. Estos incluyen al péptido natriurético auricular (secretado principalmente por el miocito auricular), al péptido natriurético cerebral (BNP, por sus siglas en inglés), secretado por el miocito ventricular (la denominación se debe a que fue aislado por primera vez en el cerebro porcino), y el péptido natriurético tipo C (expresado principalmente en las células endoteliales)1,39.
El BNP y su forma inactiva o fracción aminoterminal del propéptido cerebral (NT-proBNP), derivan a su vez de un precursor (proBNP), que se libera a la circulación desde los miocitos ventriculares en respuesta a un aumento del estrés parietal, como la isquemia miocárdica39, aunque hay diferencias en parámetros cinéticos y analíticos, sus papeles en la clínica son iguales40.
Los PN se sintetizan de precursores polipeptídicos, y junto con el sistema nervioso simpático y otras hormonas desempeñan un papel importante en la homeostasis41. Los efectos fisiológicos del BNP incluyen la vasodilatación periférica, la estimulación de la natriuresis, la inhibición de los sistemas nervioso-simpático y renina-angiotensina-aldosterona, y el crecimiento de los huesos largos, entre otros1,42.
Esto hace al BNP un marcador diagnóstico útil para varias condiciones fisiopatológicas. Se han encontrado concentraciones de PN en situaciones de tensión, trauma, hipotensión y sepsis grave, fracaso multiorgánico, trastornos intrínsecos del miocardio e hipertensión y embolia pulmonar40,43,44.
Los PN son sensibles como herramientas de diagnóstico, pero les falta especificidad para excluir o incluir pacientes con SCA. Estos podrían aportar información pronóstica en SCA, independientemente de la estratificación de riesgo clásica, y es controversial su papel en el diagnóstico precoz del dolor torácico agudo. Los episodios de isquemia miocárdica aumentan el estrés de la pared ventricular y los PN se liberan al torrente sanguíneo, además de que la isquemia por sí misma, también facilita su liberación45, por lo que pueden detectarse antes de que suceda la necrosis del miocito o en ausencia de esta, y por consiguiente, son detectables en pacientes con SCA y TnT-US normal o todavía normal, lo que pudiera dar un valor adicional al BNP, al aumentar la sensibilidad del diagnóstico precoz del dolor torácico isquémico cuando se añade a la detección de los marcadores tradicionales46.
Estudios en todo el espectro de los SCA, incluidos los pacientes con troponina normal, han demostrado que un incremento de los PN se asocia a mayor riesgo de episodios cardiovasculares. Además, en algunos de estos estudios, el valor pronóstico fue adicional al proporcionado por la troponina. Específicamente en pacientes con dolor torácico y troponina normal evaluados en unidades de dolor torácico, la elevación de NT-proBNP aumentó el riesgo de muerte o IAM al año de seguimiento47,48. Se ha señalado que las bajas cifras de NT-proBNP en el dolor torácico con troponina normal, podrían identificar a los pacientes de menor riesgo que serían egresados desde el servicio de urgencias49,50. Asimismo, en prevención primaria, la elevación de los PN permitió identificar isquemias asintomáticas51.
En este sentido, Sanchis et al.36 al analizar el papel del NT- proBNP, añadido a la determinación de TnT-US en el diagnóstico y pronóstico a corto plazo de pacientes con dolor torácico en servicios de urgencias, y que presentaban cifras normales de TnC convencional en 2 determinaciones seriadas (6 y 8 horas); encontraron que el NT-proBNP mostró un valor marginal para la evaluación del dolor torácico de origen incierto, cuando se utiliza la TnT-US; por lo que carece de valor adicional para predecir el diagnóstico o estimar el pronóstico. Entre las razones que intentan explicar estos resultados se encuentra que en los SCA, el pico de NT-proBNP aparece entre 16 y 24 horas tras el inicio de los síntomas52; es posible que una determinación a las 24 horas hubiera incrementado el valor predictivo.
A estos resultados se contraponen los obtenidos por Truong et al.53 y Melki et al.54, que concluyen que la medición adicional del NT-proBNP mejoran la capacidad diagnóstica53 y pronóstica54 en la atención inicial de pacientes evaluados con pruebas de TnT-US. Los puntos de corte elegidos para el NT-proBNP por Sanchis et al.36, Truong et al.53, y Melki et al.54 fueron 125, 50 y 300 ng/l, respectivamente, los que se seleccionaron arbitrariamente, pues no hay valores de referencia establecidos para su utilización en el diagnóstico de SCA y en ninguno de estos trabajos se han sopesado los múltiples factores que influyen a la hora de considerar qué valores de PN son normales (edad, sexo, masa magra corporal, insuficiencia renal)1,55.
La relación de BNP con el binomio isquemia miocárdica - disfunción sistólica del ventrículo izquierdo (DSVI) fue estudiada por Nadir et al.56, quién concluye, en 3 poblaciones separadas, que un valor desproporcionadamente alto de BNP para el grado de DSVI podría deberse a una isquemia insospechada, y un valor muy bajo de este biomarcador podría ser útil para descartar la isquemia en presencia de tal disfunción.
La utilidad clínica del BNP se ha establecido en distintas situaciones clínicas en el contexto de la DSVI asintomática y la IC clínica, y ha sido valorada como posible método para el cribado de la DSVI57,58.
En la IC la secreción de estos péptidos aumenta con la progresión de la enfermedad, y la medición de su concentración plasmática se ha convertido en una útil herramienta diagnóstica, pronóstica y de evaluación de la respuesta al tratamiento. De esta forma, la determinación de BNP o NT-proBNP está incluida en el algoritmo diagnóstico de la IC aguda y crónica recomendado en las guías de práctica clínica vigentes. El principal valor de esta determinación reside en su alto VPN, que permite descartar IC cuando sus concentraciones no están aumentadas59.
Sin embargo, aunque los valores bajos de BNP (< 100 pg/ml) excluyen la IC, y los valores muy elevados (> 400 pg/ml) apoyan fuertemente el diagnóstico, hay una amplia zona gris (valores entre 100 y 400 pg/ml) donde las dudas diagnósticas se mantienen58.
Dentro de los escenarios de utilidad del BNP en la IC, la detección precoz de la DSVI es aún un asunto por dilucidar. Lobos et al.58 concluyen que el BNP puede tener utilidad en el diagnóstico precoz de DSVI en pacientes de alto riesgo de IC en atención primaria, con similares valores de sensibilidad y especificidad. Al utilizar un punto de corte de 71 pg/ml se alcanza un elevado VPN (> 96 %). Niveles de BNP < 100 pg/ml (o un NT-proBNP < 300 pg/ml), permiten descartar una IC aguda en 9 de cada 10 casos.
El estudio PROBE-HF60 encontró una sensibilidad de 100 % y un VPN de 99,5 % para detectar disfunción ventricular asintomática (sistólica y diastólica moderada o grave), al utilizar el NT-proBNP con un mejor punto de corte de 125 pg/ml.
En este sentido, Jacob et al.61 analizaron, con los datos del registro Epidemiology Acute Heart Failure Emergency (EAHFE)62, el valor pronóstico del BNP en pacientes con IC aguda atendidos en servicios de urgencias hospitalarios, y concluyeron que si bien la determinación del BNP tiene valor pronóstico en un individuo concreto que consulta por IC aguda en urgencias, dicho valor pierde interés ante el hecho de que en los pacientes en los que no se determina este BNP el pronóstico es similar, sin impacto en la supervivencia. Estos mismos autores61,62 señalan que muchas de las publicaciones revisadas coinciden en que aún quedan interrogantes en este campo, como valorar las posibles implicaciones clínicas, terapéuticas y económicas de esta intervención.
En resumen, la utilidad del BNP en la IC es como sigue:
La determinación de BNP es muy útil en pacientes con disnea para descartar su origen cardíaco (VPN 98 %), por lo que se incluye actualmente en el algoritmo diagnóstico inicial de la IC en la guías de práctica clínica.
En pacientes asintomáticos hay dudas sobre su pertinencia en el cribado de la disfunción ventricular sistólica, por lo que no parece indicado en la comunidad o en la población de bajo riesgo (baja prevalencia de la enfermedad).
En determinados subgrupos de alto riesgo se han documentado resultados positivos del cribado, pero existe cierta heterogeneidad y hay pocos estudios realizados en el ámbito de la atención primaria.
Nuevos biomarcadores
Existen docenas de nuevos marcadores de daño miocárdico, que reflejan una variedad de vías fisiopatológicas que se alteran en pacientes con SCA, y que se asocian a un incremento potencial de riesgo63-65. Estos incluyen marcadores de isquemia e inflamación (albúmina modificada por la isquemia, proteína cardíaca vinculada a ácido graso, mieloperoxidasa), disfunción vascular (metaloproteinasa-9, proteína A plasmática asociada al embarazo), estrés biomecánico (ST2, copeptina, factor diferenciador del crecimiento, GDF-15), homeostasis (fibrinógeno, activador del inhibidor del plasminógeno-1) y relacionados con el metabolismo de los lípidos (lipoproteína asociada a la fosfolipasa A2). Por una variedad de razones es imposible alcanzar el uso clínico extendido en la mayoría de estos nuevos marcadores. Algunos podrían mejorar consistentemente los marcadores establecidos (Tabla).
Tabla. Utilidad diagnóstica, pronóstica e implicación clínica de los nuevos biomarcadores9,33,40,48-51,59,66.
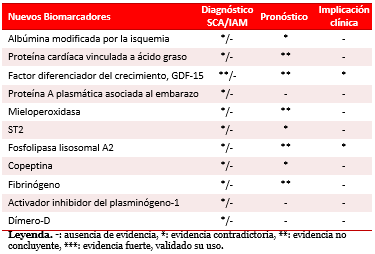
En un estudio de casos sospechosos de SCA63, ninguno de los más de 10 nuevos biomarcadores probados se acercó a la sensibilidad de la TnC en el diagnóstico del IAM. De estos, el GDF-15, que se libera en el miocito durante la isquemia y reperfusión, ha sido prometedor. En cohortes de pacientes con dolor torácico63 y SCA sin elevación del segmento ST64, el elevado nivel del GDF-15 se asocia con riesgo aumentado de muerte e IAM, independientemente de los cambios en el ECG, las TnC o los PN elevados. Además, se ha estudiado en pacientes sometidos a cirugía cardíaca65, donde predice morbilidad y mortalidad postoperatorias.
Otro marcador de inflación no específico, que se ha evaluado extensivamente en los SCA, es la proteína C reactiva. Se ha demostrado que aunque no es específico para el diagnóstico de SCA, sus niveles aumentados se asocian a peor pronóstico en pacientes con SCA66. La evidencia experimental y clínica hace pensar que la inflamación tiene un papel crucial en la iniciación y progreso de la aterosclerosis, y no se ha aclarado si la inflamación simplemente acompaña al proceso aterosclerótico o representa un papel mayor. Basados en esto, la proteína C reactiva de alta sensibilidad, es prometedora; con ella se han identificado grupos de alto riesgo de accidentes cardiovasculares recurrentes en pacientes con aterosclerosis manifiesta67.
MicroRNA
El microRNA (miRNA) se perfila como el biomarcador más prometedor en las enfermedades cardiovasculares. Son moléculas pequeñas, no codificadoras, que actúan como reguladores negativos de la expresión de genes68, envueltos en una amplia gama de procesos biológicos y en el control de importantes funciones celulares69.
La identificación de miRNA específicos como importantes reguladores de la biología celular ha abierto nuevas puertas en la clínica, al usarlos como herramientas en el diagnóstico, pronóstico y estrategia terapéutica68. Se ha demostrado que el miRNA juega un papel fisiológico en la homeostasis cardiovascular y en la patogénesis de las enfermedades cardiovasculares. Altas o bajas expresiones de ellos son causa o consecuencia de procesos patológicos70,71. Varios de estos biomarcadores, tienen un prometedor potencial como el miRNA 423-5p, que se expresa en el miocito y aumenta en la sangre de pacientes con IC, así como los miRNA-145, -155, -92a, -17 y -126, que se alteran significativamente en pacientes con enfermedad arterial coronaria comparado con el grupo control72.
La expresión cardíaca de miRNA después de un IAM se evidencia en el miRNA-1, -29b, -126, y -499, con una baja expresión una semana después del IAM; estos miRNA recuperan su expresión normal básica a los 14 días del SCA73. En contraste, otro estudio reveló que los miRNA-1 y -206, se encuentran aumentados en un período de semanas, luego del IAM en el ventrículo infartado74.
La reducción de miRNA en la zona peri-infarto podría reflejar un miocardio viable75. En muestras de corazón humano se ha encontrado que los miRNA-1 y -133a/b tenían una baja expresión en el tejido infartado y el miRNA-1, alta expresión en tejidos remotos. Además, altas expresiones de miRNA-21, -214 y -233; y baja expresión de miRNA-29b y -143 se han encontrado en zonas fronterizas de miocardio infartado de humanos76.
El IAM puede inducir un modelo de expresión específico de miRNA que estaría directamente relacionado con un daño específico de las células miocárdicas, lo que hace de estos un blanco terapéutico potencial para reducir el daño miocárdico, influir en el remodelado adverso y en la escena clínica del IAM75.
Actualmente existen aproximadamente 20 estudios clínicos diseñados para investigar si los miRNA circulantes pueden servir como biomarcadores de daño miocárdico. Los niveles de expresión de miRNA circulantes en las enfermedades cardiovasculares, su estabilidad y aparición temprana, los hacen sumamente convenientes como biomarcadores para el SCA.
Recientemente se ha demostrado la asociación de miRNA circulantes con lesiones miocárdicas77. Comparado con las TnC, los miRNA están perceptibles en la circulación más tempranamente después de un IAM (esto se explica porque las TnC son parte del aparato miofibrilar contráctil que son complejos de proteínas grandes, y los miRNA son proteínas más pequeñas que se liberan de forma controlada; lo que explica la diferencia de tiempo en la descarga luego de un IAM), lo que puede beneficiar en el diagnóstico de IAM y en la terapia de revascularización75.
Tres estudios han investigado los miRNA en pacientes con dolor torácico sospechoso de IAM que se presentan a urgencias78-80. En una comparación de múltiples miRNA, estos mostraron un incremento en la especificidad y sensibilidad en el diagnóstico de IAM78,81. Incluso cuando se combinaron con TnT-US y con un modelo clínico (historia clínica y factores de riesgo cardiovascular), los miRNA agregaron poder discriminativo que apoya la teoría de que pueden usarse como marcadores de diagnóstico temprano independiente de SCA. La valoración combinada de miRNA circulantes y TnC podría usarse para aumentar la especificidad y sensibilidad en el diagnóstico del IAM.
En conclusión, los miRNA son prometedores para la enfermedad arterial coronaria sintomática y asintomática, y proporciona información valiosa para el diagnóstico y pronóstico de estos pacientes. Además, pudieran sustituir a los biomarcadores establecidos, pero para ello habrá que vencer desafíos en su aplicación clínica rutinaria; primero, lograr un mayor conocimiento de su composición sanguínea y segundo, mejorar problemas técnicos en su determinación82.
Por su parte, Lin et al.83, en una revisión de la evidencia del uso de nuevos biomarcadores en el diagnóstico de SCA, en pacientes con dolor torácico y clínica sugestiva de isquemia miocárdica, concluyen que hay poca evidencia del uso rutinario de nuevos biomarcadores; sin embargo, varios de ellos tienen el potencial para mejorar la sensibilidad de diagnosticar los SCA cuando se combinan con TnC.
Estrategia multimarcador
La dirección correcta a seguir en los SCA, está muy ligada a su reconocimiento temprano, para una adecuada estratificación del pronóstico84. En un estudio de Bhardwaj et al.33, cuyo objetivo fue evaluar el papel de los nuevos biomarcadores frente a los ya establecidos en la evolución diagnóstica del SCA, se estudiaron pacientes con dolor torácico que acudieron a urgencias y se evaluó el valor diagnóstico de 5 biomarcadores, NT-proBNP, albúmina modificada por la isquemia, proteína cardíaca vinculada a ácido graso, TnC I-US y ácidos grasos libres, para detectar los pacientes con SCA, comparados con TnC T. Se llegó a la conclusión de que en estos pacientes ni la albúmina modificada, ni la proteína cardíaca vinculada a ácido graso, detectaban ni excluían los SCA; mientras que el NP-proBNP, la TnI-US y los ácidos grasos libres agregaron información al diagnóstico con TnT.
En otro estudio, que compara la TnC sola con una estrategia dual (TnT más PN)53, con el objetivo de mejorar el diagnóstico de SCA en una sola muestra de sangre y proporcionar información fisiológica de la enfermedad cardiovascular en pacientes que acuden a urgencias con dolor torácico; los pacientes con SCA tenían concentraciones más altas de cada biomarcador comparados con los que no lo presentaban (p < 0.01). Al agregar el PN, específicamente el NT-proBNP, a ambas troponinas (TnC y TnT-US), se reclasificaron los episodios. Los resultados con estrategia dual negativa mejoraron la sensibilidad (TnC T de 38 % a 83-86 %; la TnT-US de 59 a 86-90 %) y los valores predictivos negativos (la TnC de 94 % a 97-98 %; la TnT-US de 96 a 97-98 %) para los SCA. Se concluyó que en pacientes con una probabilidad de baja a intermedia de SCA, la combinación de PN con TnC o TnT-US mejora la capacidad diagnóstica y permite reclasificar a los pacientes con sospecha de SCA. Estos datos se contraponen a los resultados del estudio presentado por Sanchis et al.36, ya comentados anteriormente.
Conclusiones
Los biomarcadores son una herramienta esencial para la valoración de pacientes con dolor torácico. Nada puede superar el sentido común y la interpretación clínica en cada situación. Hasta el momento es difícil superar la alta sensibilidad y el VPN cercano al 100 % para la detección del daño miocárdico, conseguido con los nuevos métodos de medición de las TnC-US. Se necesitan más estudios, con diseños específicos, para profundizar en la aplicación de los biomarcadores disponibles.
Referencias bibliográficas
Fernández R, Fernández A. Panel multimarcador para pacientes con dolor torácico: ¿está todo dicho? Rev Esp Cardiol. 2013;66(7):523-5.
Singh V, Martinezclark P, Pascual M, Shaw ES, O´Neill WW. Cardiac biomarkers – The old and the new: a review. Coron Artery Dis. 2010;21(4):244-56.
Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD, et al. Third universal definition of myocardial infarction. Eur Heart J. 2012;33(20):2551-67.
Parsonage WA, Cullen L, Younger JF. The approach to patient with possible cardiac chest pain. Med J Aust. 2013;199(1):30-4.
Jaffe AS, Babuin L, Apple FS. Biomarkers in acute cardiac disease. J Am Coll Cardiol. 2006;48(1):1-11.
White HD. Pathobiology of troponin elevations: do elevations occur with myocardial ischemia as well as necrosis? J Am Coll Cardiol. 2011;57(24):2406-8.
Giannitsis E, Katus HA. Cardiac troponin level elevations not related to acute coronary syndromes. Nat Rev Cardiol. 2013;10(11):623-34.
Apple FS, Jesse RL, Newby LK, Wu AHB, Christenson RH. National Academy of Clinical Biochemistry and IFCC Committee for Standardization of Markers of Cardiac Damage Laboratory Medicine Practice Guidelines: Analytical issues for biochemical markers of acute coronary syndromes. Circulation. 2007;115(13):e352-5.
Morrow DA, Cannon CP, Jesse RL, Newby LK, Ravkilde J, Storrow AB, et al. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines: Clinical characteristics and utilization of biochemical markers of acute coronary syndromes. Circulation. 2007;115(13):e356-75.
de Lemos JA. Increasingly sensitive assays for cardiac troponins: a review. JAMA. 2013;309(21):2262-9.
Thygesen K, Mair J, Katus H, Plebani M, Venge P, Collinson P, et al. Recommendations for the use of cardiac troponin measurement in acute cardiac care. Eur Heart J. 2010;31(18):2197-204.
Thygesen K, Mair J, Giannitsis E, Mueller C, Lindahl B, Blankenberg S, et al. How to use high sensitivity cardiac troponins in acute cardiac care. Eur Heart J. 2012;33(18):2252-7.
Mills NL, Churchhouse AM, Lee KK, Anand A, Gamble D, Shah AS, et al. Implementation of a sensitive troponin I assay and risk of recurrent myocardial infarction and death in patients with suspected acute coronary syndrome. JAMA. 2011;305(12):1210-6.
Saunders JT, Nambi V, de Limos JA, Chambless LE, Virani SS, Boerwinkle E, et al. Cardiac troponin T measured by a highly sensitive assay predicts coronary heart disease, heart failure, and mortality in the atherosclerosis risk in communities study. Circulation. 2011;123(13):1367-76.
Than M, Cullen L, Aldous S, Parsonage WA, Reid CM, Greenslade J, et al. 2-Hour accelerated diagnostic protocol to assess patients with chest pain symptoms using contemporary troponins as the only biomarker: the ADAPT trial. J Am Coll Cardiol. 2012;59(23):2091-8.
Gómez-Hospital JA, Cequier Á, Valero J, González-Costello J, Mañas P, Iràculis E, et al. El daño miocárdico mínimo durante el intervencionismo coronario percutáneo no influye en el pronóstico a largo plazo. Rev Esp Cardiol. 2009;62(6):625-32.
Fuchs S, Kornowski R, Mehran R, Lansky AJ, Satler LF, Pichard AD, et al. Prognostic value of cardiac troponin I levels following catheter-based coronary interventions. Am J Cardiol. 2000;85(9):1077-82.
Cavallini C, Savonitto S, Violini R, Arraiz G, Plebani M, Olivari Z, et al. Impact of the evaluation of biochemical markers of myocardial damage on long-term mortality after percutaneous coronary intervention: results of the CK-MB and PCI study. Eur Heart J. 2005;26(15):1494-8.
Nallamothu BK, Chetcuti S, Mukherjee D, Grossman PM, Kline-Rogers E, Werns SW, et al. Prognostic implication of troponin I elevation after percutaneous coronary intervention. Am J Cardiol. 2003;91(10):1272-4.
Prasad A, Singh M, Lerman A, Lennon RJ, Holmes DR, Rihal CS. Isolated elevation in troponin T after percutaneous coronary intervention is associated with higher long-term mortality. J Am Coll Cardiol. 2006;48(9):1765-70.
Januzzi JL, Filippatos G, Nieminen M, Gheorghiade M. Troponin Elevation in Patients with Heart Failure: On Behalf of the Third Universal Definition of Myocardial Infarction Global Task Force: Heart Failure Section. Eur Heart J. 2012;33(18):2265-71.
Shave R, Baggish A, George K, Wood M, Scharhag J, Whyte G, et al. Exercise-induced cardiac troponin elevation: evidence, mechanisms, and implications. J Am Coll Cardiol. 2010;56(3):169-76.
Harper RW, Mottram P. Exercise-induced right ventricular dysplasia/cardiomyopathy – An emerging condition distinct from arrhythmogenic right ventricular dysplasia/cardiomyopathy. Heart Lung Circ. 2009;18(3):233-5.
Ector J, Ganame J, van der Merwe N, Adriaenssens B, Pison L, Willems R, et al. Reduced right ventricular ejection fraction in endurance athletes presenting with ventricular arrhythmias: a quantitative angiographic assessment. Eur Heart J. 2007;28(3):345-53.
La Gerche A, Robberecht C, Kuiperi C, Nuyens D, Willems R, de Ravel T, et al. Lower than expected desmosomal gene mutation prevalence in endurance athletes with complex ventricular arrhythmias of right ventricular origin. Heart. 2010;96(16):1268-74.
Fernández A, Pan M, Alfonso F, Aros F, Barrabés JA, Bodí V, et al. Comentarios a la guía de práctica clínica de la ESC para el manejo del síndrome coronario agudo en pacientes sin elevación persistente del segmento ST. Un informe del Grupo de Trabajo del Comité de Guías de Práctica Clínica de la Sociedad Española de Cardiología. Rev Esp Cardiol. 2012;65(2):125-30.
Reichlin T, Hochholzer W, Bassetti S, Steuer S, Stelzig C, Hartwiger S, et al. Early diagnosis of myocardial infarction with sensitive cardiac troponin assays. N Engl J Med. 2009;361(9):858-67.
Bonaca M, Scirica B, Sabatine M, Dalby A, Spinar J, Murphy SA, et al. Prospective evaluation of the prognostic implications of improved assay performance with a sensitive assay for cardiac troponin I. J Am Coll Cardiol. 2010;55(19):2118-24.
Weber M, Bazzino O, Navarro JL, De Miguel R, Salzberg S, Fuselli JJ, et al. Improved diagnostic and prognostic performance of a new high-sensitive troponin T assay in patients with acute coronary syndrome. Am Heart J. 2011;162(1):81-8.
Tsounis D, Deftereos S, Bouras G, Giannopoulos G, Anatoliotakis N, Raisakis K, et al. High sensitivity troponin in cardiovascular disease. Is there more than a marker of myocardial death? Curr Top Med Chem. 2013;13(2):201-15.
Baker JO, Reinhold J, Redwood S, Marber MS. Troponins: redefining their limits. Heart. 2011;97(6):447-52.
Morrow DA. Clinical application of sensitive troponin assays. N Engl J Med. 2009;361(9):913-5.
Bhardwaj A, Truong QA, Peacock WF, Yeo KT, Storrow A, Thomas S, et al. A multicenter comparison of established and emerging cardiac biomarkers for the diagnostic evaluation of chest pain in the emergency department. Am Heart J. 2011;162(2):276-82.
Hammerer A, Ploner T, Neururer S, Schratzberger P, Griesmacher A, Pachinger O, et al. High-Sensitivity Cardiac Troponin T Compared With Standard Troponin T Testing on Emergency Department Admission: How Much Does It Add in Everyday Clinical Practice? J Am Heart Assoc [Internet]. 2013 [citado 2013 Oct 11];2(3):e000204. Disponible en: http://jaha.ahajournals.org/content/2/3/e000204.full.pdf+html
Sanchis J, Bardají A, Bosch X, Loma-Osorio P, Marín F, Sánchez PL, et al. Usefulness of high-sensitivity troponin T for the evaluation of patients with acute chest pain and no or minimal myocardial damage. Am Heart J. 2012;164(2):194-200.
Sanchis J, Bardají A, Bosch X, Loma-Osorio P, Marín F, Sánchez PL, et al. Fracción aminoterminal del propéptido natriurético cerebral y troponina ultrasensible en el dolor torácico agudo de origen incierto. Un subestudio del estudio PITAGORAS. Rev Esp Cardiol. 2013;66(7):532-8.
Apple FS, Quist HE, Doyle PJ, Otto AP, Murakami MM. Plasma 99th percentile reference limits for cardiac troponin and creatine kinase MB mass for use with European Society of Cardiology/American College of Cardiology consensus recommendations. Clin Chem. 2003;49(8):1331-6.
Ricciardi MJ, Wu E, Davidson CJ, Choi KM, Klocke FJ, Bonow RO, et al. Visualization of discrete microinfarction after percutaneous coronary intervention associated with mild creatine kinase-MB elevation. Circulation. 2001;103(23):2780-3.
Hama N, Itoh H, Shirakami G, Nakagawa O, Suga S, Ogawa Y, et al. Rapid ventricular induction of brain natriuretic peptide gene expression in experimental acute myocardial infarction. Circulation. 1995;92(6):1558-64.
Scirica BM. Acute coronary syndrome: emerging tools for diagnosis and risk assessment. J Am Coll Cardiol. 2010;55(14):1403-15.
Szabó G, Rigó J, Nagy B. Physiology and clinical role of natriuretic peptide. Orv Hetil. 2011;152(26):1025-34.
Jerczyńska H, Pawłowska Z. Natriuretic peptides – Their receptors and role in cardiovascular system. Postepy Biochem. 2008;54(1):35-42.
Nishikimi T, Kuwahara K, Nakao K. Current biochemistry, molecular biology, and clinical relevance of natriuretic peptides. J Cardiol. 2011;57(2):131-40.
Siemiatkowski A, Jabłonowska A. Natriuretic peptides – relevance in intensive care. Anestezjol Intens Ter. 2008;40(2):96-102.
D´Souza SP, Baxter GF. B type natriuretic peptide: a good omen in myocardial ischaemia? Heart. 2003;89(7):707-9.
Bassan R, Potsch A, Maisel A, Tura B, Villacorta H, Nogueira MV, et al. B-type natriuretic peptide: a novel early blood marker of acute myocardial infarction in patients with chest pain and no ST-segment elevation. Eur Heart J. 2005;26(3):234-40.
Scirica BM, Morrow DA, Bode C, Ruzyllo W, Ruda M, Oude Ophuis AJ, et al. Patients with acute coronary syndromes and elevated levels of natriuretic peptides: the results of the AVANT GARDE-TIMI 43 Trial. Eur Heart J. 2010;31(16):1993-2005.
Scirica BM, Sabatine MS, Jarolim P, Murphy SA, de Lemos JL, Braunwald E, et al. Assessment of multiple cardiac biomarkers in non-ST-segment elevation acute coronary syndromes: observations from the MERLIN-TIMI 36 Trial. Eur Heart J. 2011;32(6):697-705.
Thygesen K, Mair J, Mueller C, Huber K, Weber M, Plebani M, et al. Recommendations for the use of natriuretic peptides in acute cardiac care. A position statement from the Study Group on Biomarkers in Cardiology of the ESC Working Group on Acute Cardiac Care. Eur Heart J. 2012;33(16):2001-6.
McCann CJ, Glover BM, Menown IB, Moore MJ, McEneny J, Owens CG, et al. Novel biomarkers in early diagnosis of acute myocardial infarction compared with cardiac troponin T. Eur Heart J 2008;29(23):2843-50.
Nadir MA, Rekhraj S, Wei L, Lim TK, Davidson J, MacDonald TM, et al. Improving the primary prevention of cardiovascular events by using biomarkers to identify individuals with silent heart disease. J Am Coll Cardiol. 2012;60(11):960-8.
Riezebos RK, Ronner E, de Boer BA, Slaats EH, Tijssen JGP, Laarman GJ. Dynamics in N-terminal pro-brain natriuretic peptide concentration in patients with non-ST-elevation acute coronary syndrome. Am Heart J. 2005;150(6):1255-9.
Truong QA, Bayley J, Hoffmann U, Bamberg F, Schlett CL, Nagurney JT, et al. Multi-marker strategy of natriuretic peptide with either conventional or high-sensitivity troponin-T for acute coronary syndrome diagnosis in emergency department patients with chest pain: from the "Rule Out Myocardial Infarction using Computer Assisted Tomography" (ROMICAT) trial. Am Heart J. 2012;163(6):972-9.
Melki D, Lind S, Agewall S, Jernberg T. Prognostic value of combining high sensitive troponin T and N-terminal pro B-type natriuretic peptide in chest pain patients with no persistent ST-elevation. Clin Chim Acta. 2012;413(9-10):933-7.
Linskey K, Lewandrowski K. The role of B-type natriuretic peptide testing in patients with acute coronary syndromes. Minerva Cardioangiol. 2012;60(2):175-82.
Nadir MA, Dow E, Davidson J, Kennedy N, Lang CC, Struthers AD. Myocardial ischaemia is associated with an elevated brain natriuretic pepide level even in the presence of left ventricular systolic dysfunction. Eur J Heart Fail. 2014;16(1):56-67.
Bayés-Genís A. NTproBNP circulante, un nuevo biomarcador para el diagnóstico del paciente con disnea aguda. Rev Esp Cardiol. 2005;58(10):1142-4.
Lobos JM, Horrillo C, González-González AI, Castellanos A, Díaz S, Castellanos J, et al. Validez y utilidad del péptido ventricular natriurético tipo B (BNP) en la detección de disfunción ventricular izquierda en pacientes de alto riesgo en atención primaria. Aten Primaria. 2012;44(1):13-9.
McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Böhm M, Dickstein K, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2012;33(14):1787-847.
Betti I, Castelli G, Barchielli A, Beligni C, Boscherini V, De Luca L, et al. The role of N-terminal pro brain natriuretic peptide and echocardiography for screening asymptomatic left ventricular dysfunction in a population at high risk for heart failure. The PROBE-HF Study. J Cardiac Fail. 2009;15(5):377-84.
Jacob J, Martín-Sánchez FJ, Herrero P, Miró O, Llorens P. Los escenarios de utilidad de los péptidos natriuréticos. Aten Primaria. 2012;44(12):739-40.
Llorens P, Martín-Sánchez FJ, González JJ, Herrero P, Jacob J, Bella A, et al. Perfil clínico del paciente con insuficiencia cardiaca aguda atendido en los servicios de urgencias: Datos preliminares del Estudio EAHFE (Epidemiology Acute Heart Failure Emergency). Emergencias. 2008;20(3):154-63.
Eggers KM, Kempf T, Allhoff T, Lindahl B, Wallentin L, Wollert KC. Growth-differentiation factor-15 for early risk stratification in patients with acute chest pain. Eur Heart J. 2008;29(19):2327-35.
Wollert KC, Kempf T, Peter T, Olofsson S, James S, Johnston N, et al. Prognostic value of growth-differentiation factor-15 in patients with non-ST-elevation acute coronary syndrome. Circulation. 2007;115(8):962-71.
Heringlake M, Charitos EI, Gatz N, Käbler JH, Beilharz A, Holz D, et al. Growth differentiation factor 15: a novel risk marker adjunct to the EuroSCORE for risk stratification in cardiac surgery patients. J Am Coll Cardiol. 2013;61(6):672-81.
Morrow DA, de Lemos JA. Benchmarks for the assessment of novel cardiovascular biomarkers. Circulation 2007;115(8):949-52.
Koenig W. High-sensitivity C-reactive protein and atherosclerotic disease: from improved risk prediction to risk-guided therapy. Int J Cardiol. 2013;168(6):5126-34.
Zhou L, Zang G, Zhang G, Wang H, Zhang X, Johnston N, et al. MicroRNA and mRNA signatures in ischemia reperfusion injury in heart transplantation. PLoS One [Internet]. 2013 [citado 13 Sept 2013];8(11):e79805.[aprox. 14 p.]. Disponible en: http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0079805
Deddens JC, Colijn JM, Oerlemans MI, Pasterkamp G, Chamuleau SA, Doevendans PA, et al. Circulating microRNAs as novel biomarkers for the early diagnosis of acute coronary syndrome. J Cardiovasc Transl Res. 2013;6(6):884-98.
Mendell JT, Olson EN. MicroRNAs in stress signaling and human disease. Cell. 2012;148(6):1172-87.
Weber C. MicroRNAs: from basic mechanisms to clinical application in cardiovascular medicine. Arterioscler Thromb Vasc Biol. 2013;33(2):168-9.
Tijsen AJ, Creemers EE, Moerland PD, de Windt LJ, van der Wal AC, Kok WE, et al. MiR423-5p as a circulating biomarker for heart failure. Circ Res. 2010;106(6):1035-9.
Fichtlscherer S, De Rosa S, Fox H, Schwietz T, Fischer A, Liebetrau C, et al. Circulating microRNAs in patients with coronary artery disease. Circ Res. 2010;107(5):677-84.
Shan ZX, Lin QX, Fu YH, Deng CY, Zhou ZL, Zhu JN, et al. Upregulated expression of miR-1/miR-206 in a rat model of myocardial infarction. Biochem Biophys Res Commun. 2009;381(4):597-601.
Lindahl B. Acute coronary syndrome - the present and future role of biomarkers. Clin Chem Lab Med. 2013;51(9):1699-706.
Bostjancic E, Zidar N, Stajer D, Glavac D. MicroRNAs miR-1, miR-133a, miR-133b and miR-208 are dysregulated in human myocardial infarction. Cardiology. 2010;115(3):163-9.
Li C, Pei F, Zhu X, Duan DD, Zeng C. Circulating microRNAs as novel and sensitive biomarkers of acute myocardial Infarction. Clin Biochem. 2012;45(10-11):727-32.
Oerlemans MI, Mosterd A, Dekker MS, de Vrey EA, van Mil A, Pasterkamp G, et al. Early assessment of acute coronary syndromes in the emergency department: the potential diagnostic value of circulating microRNAs. EMBO Mol Med. 2012;4(11):1176-85.
Corsten MF, Dennert R, Jochems S, Kuznetsova T, Devaux Y, Hofstra L, et al. Circulating microRNA-208b and microRNA-499 reflect myocardial damage in cardiovascular disease. Circ Cardiovasc Genet. 2010;3(6):499-506.
Wang GK, Zhu JQ, Zhang JT, Li Q, Li Y, He J, et al. Circulating microRNA: a novel potential biomarker for early diagnosis of acute myocardial infarction in humans. Eur Heart J. 2010;31(6):659-66.
Li C, Fang Z, Jiang T, Zhang Q, Liu C, Zhang C, et al. Serum microRNAs profile from genome-wide serves as a fingerprint for diagnosis of acute myocardial infarction and angina pectoris. BMC Med Genomics [Internet]. 2013 [citado 19 Sept 2013];6:16[aprox. 9 p.]. Disponible en: http://www.biomedcentral.com/1755-8794/6/16
Van Aelst LN, Heymans S. MicroRNAs as biomarkers for ischemic heart disease. J Cardiovasc Transl Res. 2013;6(4):458-70.
Lin S, Yokoyama H, Rac VE, Brooks SC. Novel biomarkers in diagnosing cardiac ischemia in the emergency department: a systematic review. Resuscitation. 2012;83(6):684-91.
Amodio G, Antonelli G, Di Serio F. Cardiac biomarkers in acute coronary syndromes: a review. Curr Vasc Pharmacol. 2010;8(3):388-93.
Recibido: 21 de octubre de 2013
Modificado: 18 de febrero de 2014
Aceptado: 20 de marzo de 2014
Subir






















