CorSalud 2012 Jul-Sep;4(3):191-200
ARTÍCULO DE REVISIÓN
APLICACIONES CLÍNICAS DE LAS TÉCNICAS NUCLEARES EN EL ESTUDIO DEL SINCRONISMO VENTRICULAR
Dra.Cs. Amalia Peix González
______________
Doctora en Ciencias Médicas, Investigadora y Profesora Titular. Instituto de Cardiología y Cirugía Cardiovascular. La Habana, Cuba.
Correo electrónico: peix@infomed.sld.cu
Resumen
Técnicas incruentas como la ecocardiografía, la resonancia magnética nuclear y los estudios de Medicina Nuclear (ventriculografía radioisotópica y gammagrafía de perfusión miocárdica con tomografía de emisión de fotón único), proporcionan información indirecta sobre el sincronismo ventricular cuando se utilizan parámetros de contractilidad mecánica. El análisis de fase de Fourier es un instrumento útil para el empleo de técnicas nucleares con este propósito y se ha aplicado, tanto en la ventriculografía radioisotópica como en la gammagrafía de perfusión. En este trabajo se presenta una revisión en el tiempo de los fundamentos y aplicaciones clínicas de las técnicas nucleares en el estudio del sincronismo ventricular. En la actualidad es la gammagrafía SPECT-gatillada, dentro de las técnicas nucleares, la más utilizada, por la posibilidad que ofrece de evaluar perfusión, función y sincronismo intraventricular en el mismo examen.
Palabras clave: Medicina Nuclear, Tomografía Computarizada de Emisión de Fotón Único, Cintigrafía, Terapia de Resincronización Cardíaca
Abstract
Noninvasive techniques such as echocardiography, nuclear magnetic resonance imaging and nuclear medicine studies (radionuclide ventriculography and myocardial perfusion scintigraphy with single photon emission tomography), provide indirect information about ventricular synchronism when parameters of mechanical contractility are used. The Fourier phase analysis is a useful tool for the use of nuclear techniques for this purpose, and has been applied in both radionuclide ventriculography and perfusion scintigraphy. A review in time of the basics and clinical applications of nuclear techniques in the study of ventricular synchronism is presented in this article. Nowadays, the gated-SPECT scintigraphy is the most common among nuclear techniques because it allows assessing perfusion, function, and intraventricular synchronism in the same test.
Key words: Nuclear Medicine, Single-Photon Emission-Computed Tomography, Radionuclide Imaging, Cardiac Resynchronization Therapy
Introducción
Si bien el estudio de las vías de conducción cardíacas suele hacerse a través de métodos invasivos, como la electrofisiología; algunas técnicas incruentas, como la ecocardiografía, la resonancia magnética nuclear y las técnicas nucleares: ventriculografía radioisotópica (VRI), gammagrafía de perfusión miocárdica (GPM) con tomografía de emisión de fotón único (SPECT, siglas en inglés) gatillada, proporcionan información indirecta al utilizar parámetros de contractilidad. Existen diferentes publicaciones sobre el aporte de la ecocardiografía (la más ampliamente utilizada)1-4 y de la resonancia magnética nuclear5, en la evaluación del sincronismo ventricular. Sin embargo, la aplicación de las técnicas nucleares, iniciada hace una década con el empleo de la VRI6-8, ha comenzado a extenderse recientemente con el uso del SPECT-gatillado, donde con el mismo examen se permite obtener información acerca de la perfusión miocárdica (presencia de isquemia miocárdica y estratificación de riesgo, tamaño de la necrosis y detección de viabilidad), la función ventricular y el sincronismo intraventricular. El propósito de este trabajo es precisamente, presentar una revisión de los fundamentos y aplicaciones clínicas de las técnicas nucleares en el estudio del sincronismo ventricular.
Ventriculografía radioisotópica
La VRI se realiza utilizando como radiofármaco los glóbulos rojos marcados in vivo con tecnecio-99metaestable (Tc-99m), y generalmente, se adquieren las imágenes en la proyección oblicua anterior izquierda (OAI), a 35° con 10° de desviación caudal. Permite el análisis de la función sistólica ventricular izquierda [incluida la evaluación de la contractilidad segmentaria y la fracción de eyección de ventrículo izquierdo (FEVI)] y diastólica, así como la evaluación de la función del ventrículo derecho y el cálculo de los volúmenes ventriculares.
Consideraciones técnicas para el análisis del sincronismo ventricular
El análisis de fase en una VRI proporciona una imagen funcional, dada por el análisis de Fourier píxel por píxel de la curva de radiactividad en la mezcla sanguínea versus tiempo, donde el ángulo de fase de cada píxel, analizado en el borde endocárdico, es proporcional al momento de la máxima reducción del conteo, lo que equivale al momento de la máxima motilidad ventricular8. Lo anterior constituye un mapa paramétrico de la secuencia de la contracción9, lo que permite localizar la primocontracción (relacionada con la primodespolarización) y analizar así el sincronismo ventricular. La dirección principal de los cambios de fase en la VRI corresponde a la estimulación eléctrica ventricular10. De ahí que podamos decir que la imagen de fase, que es una imagen de tiempo, al indicar el momento de mínimo volumen de cada punto, evidencia los asincronismos regionales de la contracción.
En condiciones normales ambos ventrículos muestran la misma fase (contracción sincrónica), mientras que las aurículas exhiben una diferencia de fase de 180° respecto a los ventrículos, equivalente a medio ciclo. Si en un eje de coordenadas representamos en las abscisas los distintos valores de la fase en grados, y en las ordenadas el número de elementos de la imagen que están en la misma fase, obtenemos el histograma de fase. En las figuras 1 y 2 se presentan ejemplos de histogramas normales para el análisis del sincronismo inter (Figura 1) e intraventricular (Figura 2).
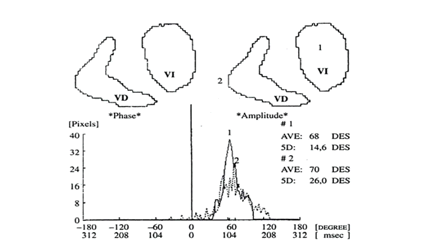
Figura 1. Gráfica de las regiones de interés sobre los ventrículos derecho e izquierdo obtenidas en el análisis de fase de Fourier en una ventriculografía radioisotópica, así como los histogramas de fase correspondientes a ambos ventrículos, que permiten analizar el sincronismo interventricular. El histograma de la línea continua corresponde al ventrículo izquierdo y el de la discontinua al derecho. Se observa que el ventrículo derecho comienza a contraerse ligeramente antes que el izquierdo. Corresponde a un sujeto normal. VD: ventrículo derecho; VI: ventrículo izquierdo.
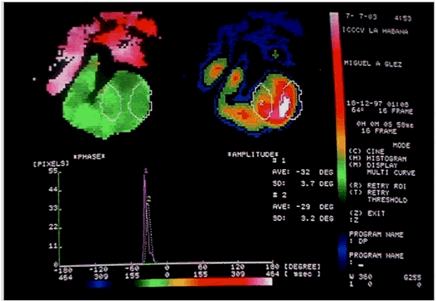
Figura 2. Se presentan las imágenes de fase y amplitud obtenidas por análisis de Fourier en una ventriculografía radioisotópica en el mismo sujeto normal de la figura 1. Se trazan las regiones de interés en pared lateral y septum de ventrículo izquierdo, y se obtienen los histogramas de fase correspondientes a ambas regiones, cuyo análisis permite evaluar el sincronismo intraventricular septum-pared lateral. PL: pared lateral; S: septum
Al emplear el análisis de la imagen de fase en una VRI son posibles dos aproximaciones para la evaluación del sincronismo ventricular: la aplicada por Kerwin et al.6 y Fauchier et al.7, y la desarrollada por Toussaint y colaboradores8,11. En el primer caso se calcula el asincronismo interventricular como la diferencia de las medias de los ángulos de fase del ventrículo izquierdo (VI) y el derecho (VD); mientras que el asincronismo intraventricular está dado por las desviaciones estándar (DE) de la media de los ángulos de fase de cada ventrículo. La media de los ángulos de fase se determina como la media aritmética de los ángulos de fase de todos los píxeles en una región de interés ventricular9,12.
En el Departamento de Medicina Nuclear del Instituto de Cardiología y Cirugía Cardiovascular de La Habana, Cuba, se comenzó la aplicación de la metodología descrita previamente por Toussaint y colaboradores8,11. La descripción detallada de dicha metodología se encuentra en ambas referencias; brevemente: se hace el análisis de fase con un software que realiza una evaluación del tercer armónico de Fourier, y se obtiene una imagen codificada en color del ángulo de fase en telesístole, de la secuencia de contracción en forma de mapa. En la OAI se obtienen el tiempo interventricular (TVD-VI), para medir el sincronismo interventricular, y el tiempo septum-pared lateral (TS-PL), para el análisis del sincronismo intraventricular septum-pared lateral. Se realizó un primer estudio en el que se incluyeron 30 individuos normales, donde se obtuvo que el VD comienza a contraerse 5 ms antes que el VI, con un tiempo de contracción total ligeramente mayor y un TVD-VI de 2±25 ms. La contracción progresó de septum a pared lateral, con un TS-PL de 4±22 ms13,14. En este sentido nuestros resultados fueron similares a los de Toussaint y colaboradores8.
Si se adquiere también la proyección lateral a 60° de la OAI empleada, es posible analizar el sincronismo intraventricular base-apex (TB-A). Según estos mismos autores8 el apex y la base se contraen sincrónicamente (TB-A = 2 ± 16 ms).
Es importante señalar que con este método sólo es posible evaluar el patrón mecánico de activación y no la propagación eléctrica del impulso cardíaco en sí mismo. No obstante, los resultados del sincronismo mecánico son muy similares a lo que cabría esperar del patrón de propagación eléctrica14.
Aplicaciones clínicas
A continuación se presentan algunos de los resultados clínicos obtenidos por diferentes autores en relación con el uso de la VRI para la evaluación del sincronismo ventricular.
Para Fauchier et al.7, quienes utilizaron el análisis de fase para evaluar el valor pronóstico de la asincronía intra e interventricular, en pacientes con miocardiopatía dilatada (MCD), la duración del QRS estuvo relacionada con ambas clases de asincronismo, pero la mayor afectación del estado hemodinámico se observó en el intraventricular. Por otra parte, en el análisis univariado, los únicos predictores independientes de sucesos cardíacos fueron el aumento de la desviación estándar de la media del ángulo de fase del VI y el aumento de la presión capilar en cuña.
Por su parte, Kerwin et al.6, demostraron que la estimulación biventricular corrige el asincronismo interventricular y que la mejoría del asincronismo se correlaciona significativamente con la de la FEVI, por lo que sugieren que el asincronismo interventricular es un parámetro corregible que contribuye a la disfunción del VI.
En cuanto a la evaluación del asincronismo base-apex, Toussaint y colaboradores11, en 21 pacientes con MCD refractaria al tratamiento y un marcado asincronismo eléctrico (duración del QRS: 180 ± 15 ms), demostraron que la estimulación biventricular, paralelamente con su efecto de resincronización interventricular, revierte la secuencia de activación base-apex, y origina una contracción precoz de la base del VI seguida por el apex. Estos cambios, junto con la mejoría de la función sistólica del VI, se mantuvieron hasta el primer año de evolución.
En nuestro centro, los primeros seis pacientes a quienes se les aplicó la terapia de resincronización cardíaca (TRC) fueron evaluados mediante el análisis de fase en una VRI15, pero la metodología aplicada en ese momento requería de un largo trabajo manual, no incorporado a un software de computación, por lo que no resultaba aplicable en la práctica clínica. Actualmente, con la posibilidad de aplicar el análisis de fase a la GPM, este inconveniente se ha resuelto, y con un solo estudio podemos obtener información, tanto de función como de sincronismo y de perfusión.
En otro trabajo posterior se estudiaron a 20 pacientes con MCD antes y cinco meses después de la TRC16. Se evaluó el sincronismo intra e interventricular mediante VRI y ecocardiografía, así como la perfusión miocárdica mediante la GPM. Luego de la TRC se observó un incremento de la FEVI de 22 ± 5 % a 29 ± 13 % (p = 0,04), así como una reducción significativa del asincronismo intraventricular entre los pacientes con enfermedad de causa isquémica. Resulta de interés señalar que no se observó diferencia entre los valores de asincronismo intra ni interventricular obtenidos por VRI o por ecocardiografía. En cuanto a la perfusión, el índice sumado de reposo se redujo sólo de 35 ± 12 a 27 ± 9 (p = NS), entre los de causa isquémica, mientras que entre los no isquémicos la reducción fue significativa: de 31 ± 17 a 17 ± 11 (p = 0,02).
En resumen, algunas ventajas del uso de la VRI son las siguientes: es un método incruento, totalmente reproducible, que permite evaluar el sincronismo intra e interventricular y al mismo tiempo, el estado de la contractilidad segmentaria, la fracción de eyección global (tanto de VI como de VD) y la regurgitación mitral, variables todas de interés en el seguimiento de pacientes con estimulación biventricular. No obstante, en el momento actual, la posibilidad de hacer la GPM con SPECT-gatillado, que permita obtener función y perfusión con el mismo estudio, ha limitado considerablemente el uso de la VRI.
Gammagrafía de perfusión miocárdica (spect-gatillado)
Consideraciones técnicas
En el año 2005 fue introducido el análisis de la disincronía mecánica de VI al emplear el análisis de fase en el SPECT-gatillado, lo que permite la evaluación simultánea de la perfusión, la función y el sincronismo17. Comparándolo con las otras modalidades de imagen previamente señaladas, el análisis de fase con el SPECT-gatillado ofrece ventajas, como: simplicidad de aplicación del software, disponibilidad, mejor reproducibilidad, aplicabilidad a los datos retrospectivos de estudios previamente realizados, así como la capacidad de evaluar simultáneamente la localización y complejidad de la cicatriz miocárdica, para optimizar así la TRC en los pacientes con insuficiencia cardíaca.
El análisis de fase se basa en el efecto conocido como de volumen parcial, el que establece que los máximos conteos regionales en el VI en las imágenes de SPECT-gatillado son prácticamente proporcionales al grosor de la pared miocárdica en la misma región18. Por lo tanto, la variación de los conteos máximos regionales durante el ciclo cardíaco representa el engrosamiento sistólico de la pared miocárdica de esa misma región. Si entonces se hace el análisis de fase, las funciones de los armónicos de Fourier permiten aproximar esta variación para medir el inicio de la contracción mecánica (recordar que la primocontracción está relacionada con la primodespolarización). Aquellos interesados en conocer con mayor exactitud la metodología empleada para esto pueden dirigirse a consultar artículos más detallados publicados sobre el tema17,19, que exceden el marco de esta revisión.
En la figura 3 se presenta el resultado del análisis del sincronismo intraventricular en un sujeto normal. Se calculan cinco índices cuantitativos:
1. Pico de la fase: es la fase más frecuente (corresponde con el pico del histograma de fase).
2. Desviación estándar de la fase (DEF): la desviación estándar de la distribución de fase.
3. Ancho de banda del histograma de fase (ABHF): incluye el 95 % de los elementos en la distribución de la fase.
4. Simetría del histograma de fase.
5. Curtosis del histograma de fase: indica cómo el histograma llega a su máximo valor.
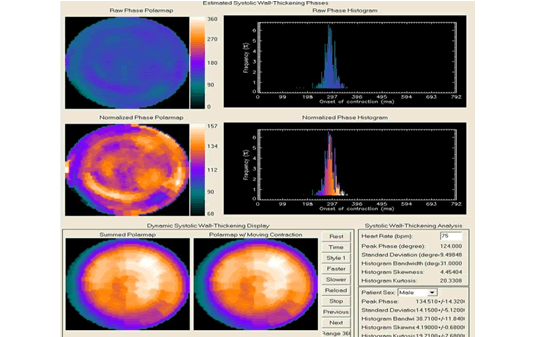
Figura 3. Imágenes correspondientes al estudio del sincronismo intraventricular en un individuo normal. Obsérvense los valores normales de la desviación estándar de la fase y del ancho de banda del histograma.
Se ha comprobado20 que los dos índices que miden el asincronismo mecánico global son la DEF y el ancho de banda del histograma. En la tabla 1 se presentan los valores normales de estos parámetros.
Tabla 1. Valores normales de los parámetros medidos en el histograma de fase.
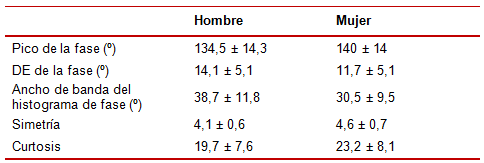
DE: desviación estándar
En un estudio de 75 pacientes a quienes se les aplicó TRC, Henneman y colaboradores20, encontraron una correlación excelente entre los parámetros derivados del análisis de fase y los del ecocardiograma bidimensional para la evaluación del asincronismo mecánico (DEF: r = 0.80, p < 0.0001 y ABHF: r = 0.89, p < 0.0001). También se ha obtenido una buena correlación con ambos parámetros con el empleo del ecocardiografía tridimensional21.
Aplicaciones clínicas
• En pacientes con enfermedad coronaria
AlJaroudi y colaboradores22 compararon pacientes con defectos reversibles de perfusión (isquemia) que afectaban más de un 10 % del VI y una FEVI normal (grupo 1, n = 20), y pacientes con perfusión normal (grupo 2, n = 20), a quienes se les realizó GPM con protocolo estrés-reposo. No encontraron cambios significativos de reposo a esfuerzo entre ambos grupos para los valores de la DEF y del ABHF (0,2 ± 3,1° vs. 1,4 ± 4,7°, y 2 ± 13° vs. 5 ± 13°, respectivamente, p = NS, grupo 1 vs. 2). Tampoco hallaron correlación entre el tamaño del defecto (representación de la extensión de la isquemia) y el cambio de la DEF o del ABHF. Pero en relación con esto es importante recordar que si bien la adquisición de imágenes con compuestos tecneciados (como el MIBI marcado con Tc-99m en este caso), es un reflejo de la perfusión en el momento de la inyección del radiofármaco en el máximo esfuerzo, puesto que dichos compuestos no redistribuyen, la función (motilidad de pared, FEVI y análisis de sincronismo) se adquiere en tiempo real, por lo que no es un reflejo del máximo estrés, sino del post-estrés en el momento de la adquisición, a diferencia de la perfusión. Estos mismos autores22 realizaron la adquisición del esfuerzo a la hora de la inyección del radiofármaco, lo que se considera como el tiempo promedio en los estudios habituales, pero debido a esto los datos de función y sincronismo representan un estado más similar al reposo que al esfuerzo.
En nuestro departamento, en un estudio que actualmente se realiza como parte de un proyecto de investigación con el Organismo Internacional de Energía Atómica (OIEA), donde se incluyeron pacientes con enfermedad coronaria conocida o sospechada, y se hicieron adquisiciones de las imágenes post-estrés a los 15 minutos y a la hora de la inyección del radiofármaco, se ha encontrado que sólo el ABHF fue significativamente diferente entre ambas adquisiciones post-estrés: 98,6° vs. 79,2° (15 minutos vs.1 hora, p = 0.01), así como entre las adquisiciones de reposo y 15 minutos post-estrés: 76,8° vs. 98,6° (p = 0.004). Sin embargo, si se consideraban los resultados de acuerdo con la presencia (grupo 1) o no (grupo 2) de defectos de perfusión en la gammagrafía, tanto la DEF como el ABHF fueron significativamente diferentes entre ambos grupos, únicamente en la adquisición a los 15 minutos post-estrés, con presencia de mayor asincronismo entre aquellos con isquemia: 48,4° vs. 22,8° (DEF, p = 0.008) y 121° vs. 68,2° (ABHF, p = 0.04), grupos 1 vs. 2.
Por lo tanto, el hecho de adquirir las imágenes de la gammagrafía antes de la hora de la inyección del radiofármaco podría constituir una aproximación válida para el estudio del sincronismo y de la función de VI, puesto que la disfunción ventricular postisquémica aguda (aturdimiento miocárdico/ stunning miocárdico) también puede evaluarse mejor más cerca del máximo estrés. De esta forma, los cambios que no pueden ser detectados a la hora podrían evaluarse más fácilmente. No obstante, se requiere continuar la investigación para lograr una mejor comprensión del significado de este hallazgo en la práctica clínica.
• En pacientes con insuficiencia cardíaca
Otros autores han trabajado con pacientes con disfunción de VI23-26, y han encontrado que además de las anomalías de la conducción eléctrica y de la función ventricular, también existen otros factores que pueden influir en el sincronismo intraventricular del VI. Para Trimble et al.24, por ejemplo, en 125 pacientes con FEVI < 35 %, aquellos con defectos de perfusión reversibles (isquemia) o duración prolongada del QRS, presentaron mayor asincronismo.
Por otra parte, Samad y colaboradores26, en 260 pacientes con FEVI ≤ 35 % estudiados con GPM en protocolo estrés-reposo, hallaron una prevalencia de asincronismo mecánico del 52 % en la muestra total, 71 % en los que tenían una duración del QRS > 120 ms y 39 % en aquellos con duración del QRS < 120 ms. Concluyeron que la FEVI reducida, el aumento de la duración del QRS, y la complejidad y extensión de la cicatriz miocárdica en la GPM fueron predictores independientes de asincronismo mecánico entre pacientes, en quienes predominaba el diagnóstico de enfermedad coronaria (85 %). Aunque una mayor extensión de la necrosis miocárdica tiende a correlacionarse con un mayor asincronismo, es importante tener en cuenta que también puede predecir un menor beneficio a la TRC27.
En las figuras 4, 5 y 6 se presentan las imágenes de un paciente con MCD de causa no isquémica, donde pueden observarse las alteraciones de la perfusión, de la función ventricular y del asincronismo intraventricular.
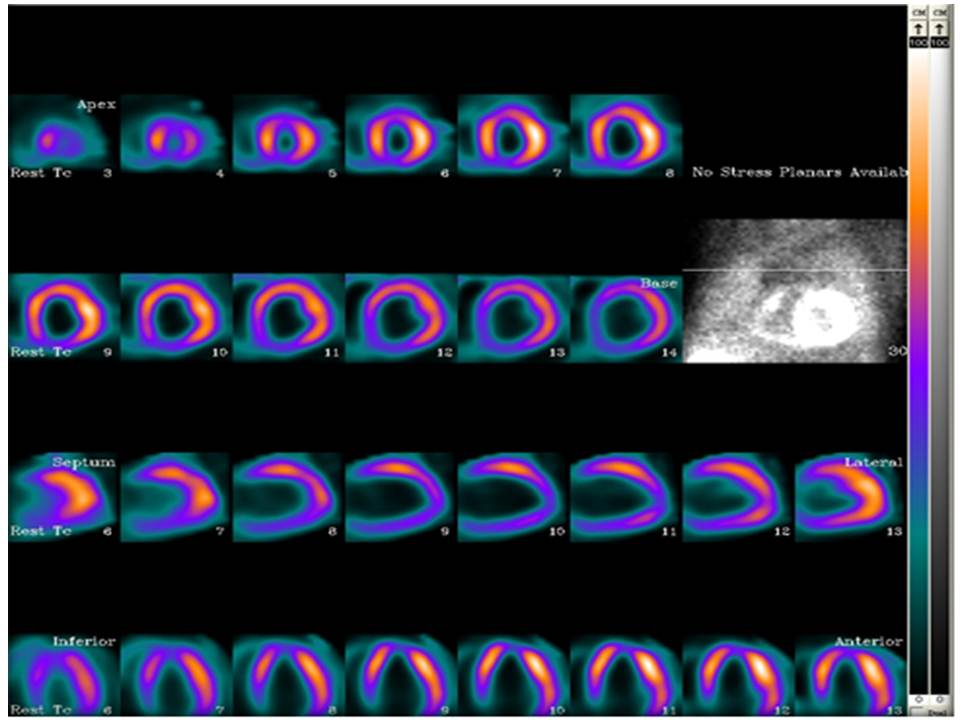
Figura 4. Imágenes de perfusión miocárdica en un paciente con diagnóstico de miocardiopatía dilatada de causa no isquémica. Se puede observar la dilatación de la cavidad ventricular, las paredes miocárdicas finas y los múltiples defectos de perfusión: apical, inferior e ínfero-septal.
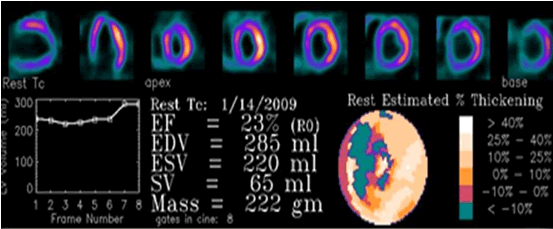
Figura 5. Imágenes correspondientes al estudio de la función ventricular en el mismo paciente de la figura 4. Puede observarse la intensa disfunción ventricular (FEVI: 23 %) y el aumento de los volúmenes ventriculares correspondientes a la miocardiopatía dilatada, así como una marcada disminución del engrosamiento sistólico de pared a nivel septal y apical. EF: siglas en inglés de fracción de eyección; EDV: siglas en inglés de volumen telediastólico; ESV: siglas en inglés de volumen telesistólico; SV: siglas en inglés de volumen sistólico.
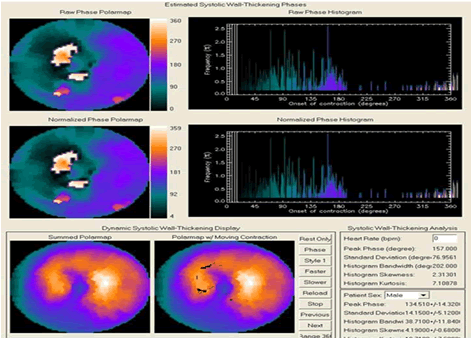
Figura 6. Imágenes correspondientes al estudio del sincronismo intraventricular en el mismo paciente de las figuras 4 y 5. Obsérvese el marcado aumento de los valores de la desviación estándar de la fase y del ancho de banda del histograma. Resulta también de interés observar el marcado ensanchamiento en la imagen del histograma, lo que contrasta con el histograma de la figura 3 correspondiente al sujeto normal.
• En pacientes con insuficiencia renal
Aljaroudi y colaboradores28, en un estudio donde incluyeron a 140 pacientes con insuficiencia renal terminal (IRT) y 133 individuos con función renal normal, informaron que la medida del asincronismo de VI no se afecta por la frecuencia cardíaca dentro del rango considerado (48-113 latidos por minuto), ya que el algoritmo del análisis de fase normaliza el ciclo RR al emplear los 360°.
Por su parte, Chen et al.29 estudiaron 121 pacientes con IRT y FEVI normal, comparándolos con 30 controles sin IRT, donde evaluaron el sincronismo, tanto sistólico como diastólico. Informaron que un 47 % de los pacientes con IRT presentaron asincronismo sistólico, mientras que el 65 % tuvieron asincronismo diastólico.
De forma similar al cálculo del inicio de la contracción mecánica que se hace en sístole para evaluar el sincronismo sistólico, puede calcularse el inicio de la relajación mecánica como medida del sincronismo diastólico del VI cuando se emplea un análisis de fase multiarmónico. Li y colaboradores30 informaron que el sincronismo diastólico tuvo una buena correlación con el pro-BNP (r > 0,8) y con la razón E/E´ (r > 0,5), obtenida por ecocardiografía.
• Para optimizar respuesta a la TRC
La TRC se indica en pacientes con insuficiencia cardíaca con clase funcional III-IV de la Asociación del Corazón de Nueva York (NYHA, por sus siglas en inglés) refractarios a tratamiento médico, FEVI ≤ 35 % y ritmo sinusal con duración del QRS ≥ 120ms31. Pero si sólo se consideran estos criterios, se ha planteado que hasta un tercio de los pacientes no responden a la TRC32-33.
De ahí el interés de emplear otras variables independientes de la evaluación clínica para tratar de hacer una mejor aproximación al diagnóstico de qué pacientes podrán beneficiarse con la TRC. La técnica de imagen más ampliamente utilizada para ello, debido a su disponibilidad, ausencia de radiaciones y relativamente fácil acceso para el cardiólogo, es -por supuesto- la ecocardiografía. No obstante, es importante tener en cuenta que para disponer de mediciones ecocardiográficas confiables se requiere de experiencia, entrenamiento y habilidad, y así los resultados pueden considerarse consistentes y reproducibles. En relación con esto, en el ensayo PROSPECT34 se obtuvo una precisión modesta para la predicción de la respuesta a la TRC, debido a la elevada variabilidad intra e interobservador del ecocardiograma.
Por su parte, el análisis de fase en la GPM con SPECT-gatillado tiene elevada reproducibilidad. Henneman y colaboradores35 demostraron que tiene una sensibilidad de 70 % y una especificidad de 74 % para predecir la respuesta clínica a la TRC, si se consideran como valores óptimos de corte 43° para la DEF y 135° para el ABHF.
Recientemente, se ha desarrollado un software que permite la evaluación integrada del sincronismo mecánico, el patrón de activación mecánica regional y el sitio de la activación mecánica más tardía con el empleo del mismo grupo de imágenes SPECT36, lo que permite cuantificar la activación mecánica regional: la región con la fase mayor es la de activación más tardía. Boogers et al. 36 estudiaron 90 pacientes con insuficiencia cardíaca, a quienes les realizaron ecocardiografía bidimensional y GPM antes de la implantación de la TRC y ecocardiografía seis meses después. Se definió la respuesta a la TRC como una disminución ≥15 % del volumen telesistólico del VI, y el sitio de la activación más tardía se definió por análisis de fase en la GPM, lo que se relacionó con la posición del electrodo en VI mediante la fluoroscopía. En 52 pacientes (58 %) el electrodo se colocó en el sitio de activación más tardía (colocación concordante), mientras que en 38 casos (42 %) se hizo fuera de este (colocación discordante). La respuesta adecuada a la TRC fue significativamente superior entre los concordantes respecto a los discordantes (79 % vs. 26 %, p < 0.01). A los seis meses, los concordantes mostraron un incremento significativo de la FEVI (27 ± 8 % vs. 35 ± 12 %, p < 0.05), al contrario de los discordantes (26 ± 8 % vs. 28 ± 9 %, p = NS). De igual forma, los concordantes tuvieron una reducción significativa del volumen telesistólico (159 ± 57 ml vs. 125 ± 54 ml, p < 0.05) en relación con los discordantes (161 ± 57 ml vs. 153 ± 53 ml, p = NS). Este software tiene una elevada reproducibilidad para la identificación del sitio de activación más tardía, lo que permite informar una elevada reproducibilidad intraobservador (kappa = 0,96, concordancia de 93 %) e interobservador (kappa = 0,92, concordancia de 87 %)36.
Otro aspecto importante a tener en cuenta para la implantación del electrodo en VI, además de la localización del sitio de activación mecánica más tardía, es la confirmación de la presencia de tejido viable en dicha zona, en los casos de miocardiopatía de causa isquémica. Ypenburg et al.37, por ejemplo, emplearon la flúor-deoxiglucosa marcada con F18 (FDG-F18) para el estudio del metabolismo miocárdico con SPECT y colimadores de 511 keV, y encontraron que la presencia de miocardio viable estuvo directamente relacionada con el incremento de la FEVI, luego de seis meses de TRC. Identificaron además, un valor de corte de 11 segmentos viables para predecir la respuesta clínica a la TRC, con una sensibilidad de 74 % y una especificidad de 87 %.
En el mismo trabajo de Boogers y colaboradores36 al considerar específicamente, la presencia de tejido viable en el sitio de implantación del electrodo, de los 52 pacientes que fueron concordantes entre el sitio de activación más tardía (determinada por el análisis de fase en la GPM) y el de implantación del electrodo, en siete de ellos, existía una cicatriz miocárdica no viable.
En los 45 restantes, donde podía considerarse que había una posición óptima del electrodo, la tasa de respuesta a la TRC fue > 90 %. Por lo tanto, puede decirse que un aspecto importante a tener en cuenta por el cardiólogo que indica la TRC, en un paciente isquémico, es conocer si el sitio de activación más tardía es viable, lo que de hecho es la indicación principal de GPM para estos pacientes en nuestro centro.
Se ha comunicado que el uso del análisis de fase en la GPM tiene un elevado valor predictivo positivo en el pronóstico de la respuesta aguda a la TRC (92 %)38, lo que también se ha relacionado con la evolución a largo plazo de estos pacientes.
Tanto el ecocardiograma como la gammagrafía de perfusión miocárdica y la resonancia magnética, ofrecen información acerca de los tres aspectos fundamentales a analizar en pacientes que van a recibir una TRC, lo que en definitiva constituye la principal aplicación del estudio del sincronismo ventricular: la existencia de asincronismo mecánico, la presencia y localización de la cicatriz miocárdica no viable en el caso de los pacientes isquémicos y el sitio de activación mecánica más tardía. Cada técnica tiene sus ventajas y desventajas, donde se incluye el importante aspecto de la reproducibilidad, pero la elección de una u otra dependerá fundamentalmente de la disponibilidad y la experiencia del centro en cuestión.
Referencias bibliográficas
Bax JJ, Bleeker GB, Marwick TH, Molhoek SG, Boersma E, Steendijk P, et al. Left ventricular dyssynchrony predicts response and prognosis after cardiac resynchronization therapy. J Am Coll Cardiol. 2004;44(9):1834-40.
Suffoleto MS, Dohi K, Cannesson M, Saba S, Gorcsan J 3rd. Novel speckle-tracking radial strain from routine black-and-white echocardiographic images to quantify dyssynchrony and predict response to cardiac resynchronization therapy. Circulation. 2006;113(7):960-8.
Galderisi M, Cattaneo F, Mondillo S. Doppler echocardiography and myocardial dyssynchrony: A practical update of old and new ultrasound technologies. Cardiovasc Ultrasound. 2007;5:28-33.
Nesser HJ, Winter S. Speckle-tracking in the evaluation of left ventricular dyssynchrony. Echocardiography. 2009;26(3):324-36.
Lardo AC, Abraham TP, Kass DA. Magnetic resonance imaging assessment of ventricular dyssynchrony: Current and emerging concepts. J Am Coll Cardiol. 2005;46(12):2223-8.
Kerwin WF, Botvinick EH, O´Connell JW, Merrick SH, DeMarco T, Chatterjee K, et al. Ventricular contraction abnormalities in dilated cardiomyopathy: effect of biventricular pacing to correct interventricular dyssynchrony. J Am Coll Cardiol. 2000;35(5):1221-7.
Fauchier L, Marie O, Casset-Senon D, Babuty D, Cosnay P, Fauchier JP. Interventricular and intraventricular dyssynchrony in idiopathic dilated cardiomyopathy: a prognostic study with Fourier phase analysis of radionuclide angioscintigraphy. J Am Coll Cardiol. 2002;40(11):2022-30.
Toussaint JF, Peix A, Lavergne T, Ponce Vicente F, Froissart M, Alonso C, et al. Reproducibility of the ventricular synchronization parameters assessed by multiharmonic phase analysis of radionuclide angiography in the normal heart. Int J Cardiovasc Imaging. 2002;18(3):187-94.
Frais M, Botvinick E, Shosa D, O'Connell WJ, Scheinman MM, Hattner RS, et al. Phase image characterization of ventricular contraction in left and right bundle branch block. Am J Cardiol. 1982;50(1):95-105.
Kondo T, Sakurai M, Watanabe Y, Kaneko K, Kato Y, Kiriyama T, et al. Estimation of ventricular activation by scintigraphic phase image analysis. J Cardiogr. 1984;14 (3):543-54.
Toussaint JF, Lavergne T, Ollitraut J, Hignette C, Darondel JM, De Dieuleveult B, et al. Biventricular pacing in severe heart failure patients reverses electromechanical dyssynchronization from apex to base. Pacing Clin Electrophysiol. 2000;23(11 Pt 2):1731-4.
Frais M, Botvinick E, Shosa D, O´Connell W, Pacheco Álvarez J, Dae M, et al. Phase image characterization of localized and generalized left ventricular contraction abnormalities. J Am Coll Cardiol. 1984;4(5):987-98.
Peix A, Ponce F, Zayas R, López A, Cabrera O, Dorticós F, et al. Evaluación de la sincronización ventricular por análisis de fase de Fourier en una ventriculografía radioisotópica. Rev Esp Med Nuclear. 2003;22(1):26-9.
Peix A. El análisis de la sincronización ventricular por imagen de fase en la ventriculografía isotópica. Su utilidad en la estimulación biventricular. En: Castro-Beiras JM, Ortega A, Paz B, Orduña MP, Cordero JM, Martínez JJ, eds. Cardiología nuclear y otras técnicas no invasivas de imagen en Cardiología. Madrid: Meditécnica, S.L; 2005. p.437-46.
Zayas R, Peix A, Castro J, Quiñones M, Fayad Y, Dorantes M, et al. Estimulación multisitio en pacientes con disfunción ventricular severa y trastornos de conducción. Rev Cubana Med [Internet]. 2000 [citado 3 Sept 2010];14(1):[aprox. 2 p.]. Disponible en: http://www.bvs.sld.cu/revistas/car/vol14_1_00/car04100.htm
Peix A, González I, Zayas R, Rodríguez L, Quiñones M, Valiente J, et al. Synchronization parameters and perfusion improvement after cardiac resynchronization therapy. Internet Journal of Cardiology [Internet]. 2008 [citado 12 Ene 2012];6(1):[aprox. 4 p.]. Disponible en: http://www.ispub.com/journal/the-internet-journal-of-cardiology/volume-6-number-1.html
Chen J, Garcia EV, Folks RD, Cooke CD, Faber TL, Tauxe EL, et al. Onset of left ventricular mechanical contraction as determined by phase analysis of ECG-gated myocardial perfusión SPECT imaging: Development of a diagnostic tool for assessment of cardiac mechanical dyssynchrony. J Nucl Cardiol. 2005;12(6):687-95.
Galt JR, Garcia EV, Robbins WL. Effects of myocardial wall thickness on SPECT quantification. IEEE Trans Med Imaging. 1990;9(2):144-50.
Henneman M, van der Wall EE, Ypenburg C, Bleeker GB, van de Veire NR, Marsan NA, et al. Nuclear imaging in cardiac resynchronization therapy. J Nucl Med. 2007;48(12):2001-10.
Henneman M, Chen J, Ypenburg C, Dibbets P, Bleeker GB, Boersma E, et al. Phase analysis of gated myocardial perfusion single-photon emission computed tomography compared with tissue Doppler imaging for the assessment of left ventricular dyssynchrony. J Am Coll Cardiol. 2007;49(16):1708-14.
Marsan NA, Henneman M, Chen J, Ypenburg C, Dibbets P, Ghio S, et al. Left ventricular dyssynchrony assessed by two three-dimensional imaging modalities: Phase analysis of gated myocardial perfusion SPECT and tri-plane tissue Doppler imaging. Eur J Nuc Med Mol Imaging. 2008;35(1):166-73.
AlJaroudi W, Koneru J, Heo J, Iskandrian AE. Impact of ischemia on left ventricular dyssynchrony by phase analysis of gated single photon emission computed tomography myocardial perfusion imaging. J Nucl Cardiol. 2011;18(1):36-42.
Trimble MA, Borges-Neto S, Smallheiser S, Chen J, Honeycutt EF, Shaw LK, et al. Evaluation of left ventricular mechanical dyssynchrony as determined by phase analysis of ECG-gated SPECT myocardial perfusión imaging in patients with left ventricular dysfunction and conduction disturbances. J Nucl Cardiol. 2007;14 (3):298-307.
Trimble MA, Borges-Neto S, Honeycutt EF, Shaw LK, Pagnanelli R, Chen J, et al. Evaluation of mechanical dyssynchrony and myocardial perfusion using phase analysis of gated SPECT imaging in patients with left ventricular dysfunction. J Nucl Cardiol. 2008;15(5):663-70.
Atchley AE, Trimble MA, Samad Z, Shaw LK, Pagnanelli R, Chen J, et al. Use of phase analysis of gated SPECT perfusion imaging to quantify dyssynchrony in patients with mild-to-moderate left ventricular dysfunction. J Nucl Cardiol 2009;16(6):888-94.
Samad Z, Atchley AE, Trimble MA, Sun JL, Shaw LK, Pagnanelli R, et al. Prevalence and predictors of mechanical dyssynchrony as defined by phase analysis in patients with left ventricular dysfunction undergoing gated SPECT myocardial perfusion imaging. J Nucl Cardiol. 2011;18(1):24-30.
Jansen AH, Bracke F, van Dantzig JM, Peels KH, Post JC, van den Bosch HC, et al. The influence of myocardial scar and dyssynchrony on reverse remodeling in cardiac resynchronization therapy. Eur J Echocardiogr. 2008;9(4):483-8.
AlJaroudi W, Iqbal F, Heo J, Iskandrian AE. Relation between heart rate and left ventricular mechanical dyssynchrony in patients with end-stage renal disease. Am J Cardiol. 2011;107(8):1235-40.
Chen J, Kalogeropoulos AP, Verdes L, Butler J, Garcia EV. Left-ventricular systolic and diastolic dyssynchrony as assessed by multi-harmonic phase analysis of gated SPECT myocardial perfusion imaging in patients with end-stage renal disease and normal LVEF. J Nucl Cardiol. 2011;18(2):299-308.
Li D, Pan C, Zhou Y. Multi-harmonic phase analysis of gated SPECT myocardial perfusion imaging compared with NT-pro-BNP and echocardiography for the assessment of left ventricular diastolic function. J Am Coll Cardiol. 2011;57(14):E637 [Resumen].
Epstein AE, DiMarco JP, Ellenbogen KA, Estes NA, Freedman RA, Gettes LS, et al. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities. J Am Coll Cardiol. 2008;51(1):e1-62.
Abraham WT, Fisher WG, Smith AL, Delurgio DB, Leon AR, Loh E, et al. Cardiac resynchronization in chronic heart failure. N Engl J Med. 2002;346:1845-53.
Young JB, Abraham WT, Smith AL, Leon AR, Lieberman R, Wilkoff B, et al. Combined cardiac resynchronization and implantable cardioversion defibrillation in advanced chronic heart failure: The MIRACLE ICD Trial. JAMA 2003;289 (20):2685-94.
Chung ES, Leon AR, Tavazzi L, Sun JP, Nihoyannopoulos P, Merlino J, et al. Results of the Predictors of Response to CRT (PROSPECT) trial. Circulation 2008;117(20):2608-16.
Henneman M, Chen J, Dibbets-Schneider P, Stokkel MP, Bleeker GB, Ypenburg C , et al. Can LV dyssynchrony as assessed with phase analysis on gated myocardial perfusion SPECT predicts response to CRT? J Nucl Med. 2007;48(20):1104-11.
Boogers MJ, Chen J, van Bommel RJ, Borleffs CJ, Dibbets-Schneider P, van der Hiel B, et al. Optimal left ventricular lead position assessed with phase analysis on gated myocardial perfusion SPECT. Eur J Nucl Med Mol Imaging. 2011;38(2):230-8.
Ypenburg C, Schalij MJ, Bleeker GB, Steendijk P, Boersma E, Dibbets-Schneider P , et al. Extent of viability to predict response to cardiac resynchronization therapy in ischemic heart failure patients. J Nucl Med. 2006;47(10):1565-70.
Friehling M, Chen J, Lin X. A novel gated SPECT-based protocol to determine changes in LV synchrony following CRT. J Nucl Cardiol. 2010;17:746 [Resumen].
Recibido: 11 de abril de 2012
Aceptado para su publicación: 14 de mayo de 2012






















