CorSalud 2012 Jul-Sep;4(3):201-215
ARTÍCULO DE REVISIÓN
VARIABLES ECOCARDIOGRÁFICAS PARA LA EVALUACIÓN INCRUENTA DE LA HEMODINÁMICA PULMONAR
Dr. Damián Pérez Cabrera1, Dr. Alain Alonso Herrera2, Dra. Yannelys Gómez García1, Dr. Luis E. Novo Choy3 y Dr. Juan Miguel Cruz Elizundia4
______________
Especialista de I Grado en Cardiología. Hospital Universitario "Arnaldo Milián Castro". Villa Clara, Cuba.
Especialista de I Grado en Cardiología. Hospital Militar "Comandante Manuel Fajardo". Villa Clara, Cuba.
Especialista de I Grado en Medicina General Integral. Diplomado en Cuidados Intensivos de Adultos. Hospital Universitario "Arnaldo Milián Castro". Villa Clara, Cuba.
Especialista de I Grado en Cardiología. Cardiocentro "Ernesto Che Guevara". Villa Clara, Cuba.
Resumen
La valoración de la hemodinámica pulmonar depende de muchas situaciones clínicas, debido a que el árbol vascular pulmonar puede verse afectado por diversas circunstancias fisiológicas y patológicas. La prueba de oro para evaluar estos parámetros es el cateterismo derecho, pero su uso no puede justificarse de manera rutinaria. Las técnicas de imágenes, especialmente la ecocardiografía, se han desarrollado vertiginosamente y permiten obtener una descripción completa y aproximada, así como de la magnitud de la repercusión en el corazón, de dichos parámetros. Varios son los índices ecocardiográficos que resultan de un interés particular en la evaluación de la hemodinámica pulmonar, y múltiples son las variables a analizar para garantizar una adecuada interpretación de los resultados y un diagnóstico ecocardiográfico certero. En este artículo se presenta una revisión de las diferentes variables ecocardiográficas involucradas en la evaluación hemodinámica pulmonar, así como la aplicación de éstas en el escenario clínico.
Palabras clave: Hipertensión pulmonar, diagnóstico, ecocardiografía
Abstract
The assessment of pulmonary hemodynamics depends on many clinical situations because the pulmonary vascular tree may be affected by various physiological and pathological circumstances. The gold test for assessing these parameters is the right heart catheterization, but its use cannot be routinely justified. Imaging techniques, especially echocardiography, have developed rapidly and allow for a full and approximate description, as well as the magnitude of the impact of these parameters on the heart. There are several echocardiographic indexes that are of particular interest in the assessment of pulmonary hemodynamics, and multiple variables should be analyzed to ensure proper interpretation of results and an accurate echocardiographic diagnosis. This article presents a review of the different echocardiographic variables involved in assessing pulmonary hemodynamics and their application in the clinical setting.
Key words: Pulmonary hypertension, diagnosis, echocardiography
Introducción
La valoración de la hemodinámica pulmonar está rodeada de muchas situaciones clínicas, no sólo debido a la relación estricta entre la hemodinámica del corazón izquierdo con la del derecho, sino también porque el árbol vascular pulmonar es un blanco potencial afectado por diversas circunstancias. El método de oro para evaluar los parámetros hemodinámicos pulmonares es el cateterismo derecho, pero su uso no puede justificarse de manera rutinaria. Las técnicas de imágenes se han desarrollado continuamente; por consiguiente, es posible obtener una descripción completa y aproximada de estos parámetros, así como de la magnitud de su repercusión en el corazón, mediante ecocardiografía.
Esta técnica se ha desarrollado mucho durante los últimos años, varios son los índices ecocardiográficos que resultan de un interés particular en la evaluación hemodinámica pulmonar, estos no sólo mejoran la sensibilidad y especificidad en la estimación de las presiones pulmonares, sino también en la evaluación de otros parámetros como: la resistencia vascular, la presión capilar, y la capacitancia e impedancia pulmonares, de valor diagnóstico y pronóstico en pacientes con insuficiencia cardíaca, enfermedad pulmonar obstructiva crónica, hipertensión arterial pulmonar, con sospecha de deterioro cardiopulmomar importante. En este artículo se presenta una revisión de diferentes variables ecocardiográficas involucradas en la evaluación hemodinámica pulmonar, así como la aplicación de éstas en la escena clínica.
Índices ecocardiográficos
Estimación de las presiones pulmonares
La hipertensión pulmonar (HTP) es una enfermedad compleja que puede ser idiopática, familiar, o asociada a una amplia gama de enfermedades. Una nueva y simplificada definición ha sido propuesta, en las más recientes guías1: aumento de la presión media de la arteria pulmonar (PMAP)>25mmHg en reposo. El diagnóstico de hipertensión arterial pulmonar primaria requiere del aumento de las resistencias vasculares pulmonares (RVP) >3 unidades Wood (UW), presión capilar pulmonar, de aurícula izquierda y presión diastólica final del ventrículo izquierdo ≤15mmHg2-4.
En la HTP muchos de los signos ecocardiográficos que pueden estar presentes involucran al ventrículo derecho (hipertrofia, dilatación, o reducción de la función sistólica)5-8. Desde hace muchos años se conoce que la ecocardiografía Doppler es de gran utilidad para estimar la presión pulmonar sistólica, pero debido a su limitada exactitud y reproducibilidad, el cateterismo cardíaco, constituye la prueba de oro para la valoración correcta de la hemodinámica del corazón derecho. Actualmente, muchos son los índices propuestos para mejorar y completar la evaluación ecocardiográfica de las presiones pulmonares9.
Presión sistólica de la arteria pulmonar (PSAP)
Es considerada igual a la presión sistólica del ventrículo derecho (PSVD) en ausencia de estenosis valvular pulmonar u obstrucción del tracto de salida del ventrículo derecho (TSVD). La PSVD puede ser determinada adicionando a la presión de la aurícula derecha (PAD) el gradiente de presión sistólico entre las cámaras derechas; el gradiente de presión entre aurícula y ventrículo derechos se calcula usando la ecuación de Bernoulli modificada:
ΔP = 4(V)2, donde V es la velocidad máxima de regurgitación tricuspídea (VRT).
En los años 80 se realizaron varios estudios para validar esta técnica, la que fue comparada con el cateterismo10-14. Aunque su aplicación, para estimar la PSAP, se ha validado ampliamente, su precisión es discutible en estudios que han comparado el valor estimado por ecocardiogrrafía con los verdaderos valores medidos por cateterismo derecho9. La diferencia fue de 3 a 38 mm Hg, y la PSAP fue infraestimada (por ecocardiografía) en más de 20 mmHg, en el 31 % de los pacientes estudiados2. En un estudio reciente con 63 pacientes, donde se compararon los resultados por ambos métodos, se observó una diferencia de ± 10 mmHg en la estimación de la PSAP2. Aunque la exactitud de su estimación mediante Doppler ha sido cuestionada4, es un método factible en pacientes con sospecha de HTP o con factores de riesgo para desarrollarla15,16. Una VRT > 2,8 m/s se corresponde con un gradiente de presión sistólico aurículo-ventricular derecho de 31 mmHg, que a su vez constituye el valor de corte para definir el aumento de las presiones pulmonares, excepto en personas mayores y pacientes muy obesos en los que estas suelen ser más elevadas17. Los posibles falsos negativos en la estimación de la PSAP mediante ecocardiografía, son probablemente debidos a una infraestimación de la PAD y de la VRT (Figura 1, Anexos 1 y 2). Para minimizar este error, la VRT debe ser medida en múltiples vistas y tomar su máximo valor18-22.
En pacientes con regurgitación tricuspídea grave la envolvente de la señal del Doppler puede cortarse al igualarse tempranamente las presiones entre aurícula y ventrículo derechos, y el uso de la ecuación de Bernoulli, que simplificada podría infraestimar el gradiente entre las cámaras derechas. El uso del Doppler color es recomendado para obtener un mejor alineamiento entre la regurgitación y la señal de Doppler, muchos estudios han demostrado la utilidad de este método al usar medios de contraste18-22. El empleo de una simple solución salina mejora la correlación entre la medición con el Doppler y el cateterismo cardíaco en la estimación de la PSAP (r = 0,64 - 0,92), en un estudio realizado por Jeon et al19. Se debe ser cuidadoso cuando se emplean medios de contraste, para evitar la sobrestimación de las velocidades del Doppler, producida por estímulos que generan artefactos. Si se presenta fibrilación auricular se debe tomar el promedio de las VRT de cinco latidos. Para el cálculo del valor medio de la PSAP se adiciona a la PAD, la integral tiempo-velocidad de la regurgitación tricuspídea (ITVRT), un novedoso método adicional, recientemente descrito, y validado por cateterismo cardíaco derecho23-24.

Figura 1. Ecocardiografía Doppler en la determinación de la presión sistólica de la arteria pulmonar (PSAP). Espectro de señal de Doppler continuo de regurgitación tricuspídea, correspondiente al gradiente de presión sistólico entre AD-VD, con una presión de AD de 4 mmHg, la
PSAP = 33,8mmHg + 4 mmHg
Métodos alternativos para la estimación de la PSAP
El tiempo de relajación isovolumétrico (TRIV) medido por Doppler hístico (tisular) puede ayudar a la estimación de la PSAP cuando la regurgitación tricuspídea no pueda ser evaluada, aproximadamente en un 15 % de los pacientes25. Particularmente el TRIV ha mostrado una alta sensibilidad en la detección de HTP, que excluye el diagnóstico si el TRIV < 40 ms (con un valor predictivo negativo del 100 %26). Debido a que el TRIV es un parámetro de duración (diastólica), y está influenciado por la frecuencia cardíaca (FC), es recomendada su corrección con el intervalo RR27 (TRIVc). En un estudio realizado por Elnoamany y Dawood28, un TRIVc > 65 ms tuvo una sensibilidad del 96 % y una especificidad del 93 %, para predecir una PSAP > 40 mmHg.
TRIVC = TRIV/√R-R (en segundos)
La mejor correlación entre PSAP y TRIV se logra cuando este último parámetro se evalúa a nivel medial y no basal del ventrículo derecho (VD)27, lo que muestra (la relación) incongruencias en pacientes con reducción significativa de la función sistólica de este mismo ventrículo28-29.
La prolongación del TRIV no es específico para un incremento de la PSAP y está estrictamente asociado con la precarga y PAD; cuando la PAD es normal, el TRIV aumenta proporcionalmente con la PSAP, pero cuando hay disfunción de la aurícula derecha o sobrecarga de volumen de esta, la PAD aumenta, y el TRIV se acorta tempranamente después de la apertura valvular tricuspídea30. Por esta razón, no debe emplearse solamente el TRIV para la estimación de la PSAP, sino que debe complementarse con los demás índices.
Está demostrado que el tiempo de aceleración pulmonar (TAP) es inversamente proporcional a la PSAP y a la PMAP31-33. Un TAP < 93 ms es altamente fiable en el 67,4 % de los pacientes con HTP para predecir un aumento de la PSAP, de ahí que en este diagnóstico sea una herramienta poderosa, en combinación con otros índices34,35.
Melek36 et al. encontraron una importante relación entre la PSAP y las variables derivadas del Doppler hístico. Estos demostraron que una velocidad de la onda sistólica (anillo tricuspídeo) ≤ 12 cm/seg con una ITV ≤ 2,5 cm tienen una sensibilidad de un 85 y 85,7 %, y una especificidad de un 93,3 y 90 %, respectivamente, para predecir una PSAP > 40 mmHg (Figura 2). Debido a que estas variables han sido comparadas solamente con mediciones incruentas de la PSAP, no deben emplearse únicamente para estimarla, en ausencia de regurgitación tricuspídea.

Figura 2. Doppler hístico del anillo tricuspídeo. Línea verde: TRIV. Roja: Velocidad sistólica.
Presión media de la arteria pulmonar
El flujograma de regurgitación pulmonar mediante ecocardiografía Doppler (Figura 3), está caracterizado por una aceleración rápida de la velocidad del flujo, inmediatamente después del cierre de la válvula pulmonar (velocidad máxima de regurgitación pulmonar), y una gradual desaceleración hasta la apertura valvular del próximo ciclo (velocidad final de regurgitación pulmonar). La velocidad máxima de regurgitación pulmonar representa el gradiente de presión diastólica entre la arteria pulmonar y el VD. Masuyama et al37 demostraron que si se aplica la ecuación de Bernoulli, con esta velocidad se podría estimar la presión media de la arteria pulmonar.

Figura 3. Flujograma de regurgitación pulmonar. La línea roja muestra la velocidad máxima de regurgitación pulmonar y la verde, la final.
Abbas et al38, en estudios más recientes, validaron este método y demostraron que sumándole la PAD mejora la exactitud de la estimación de la presión media de la arteria pulmonar. Aduen et al39 de igual manera, propusieron un nuevo y simple método para estimar la presión media de la arteria pulmonar (PMAP), a partir de la suma de la PAD y el gradiente medio (sistólico) de regurgitación tricúspídea. Este método fue validado en 102 pacientes, al compararlo con el cateterismo derecho, y ha demostrado gran fiabilidad (la media de la diferencia con estudios cruentos fue de -1,6 mmHg; el por ciento de diferencia de la mediana absoluta de 18 %), con un área bajo la curva de 0,92 (95 %), e intervalo de confianza de 0,87 - 0,97, en la exactitud del diagnóstico de HTP.
Además de las fórmulas anteriormente expuestas, la PMAP puede ser calculada mediante el tiempo de aceleración pulmonar (TAP), obtenido con Doppler pulsado, desde el inicio de la onda Q en el electrocardiograma hasta el inicio del pico de la velocidad del flujo (sistólico) pulmonar PMAP = 79 - 0,45(TAP)40. Se ha demostrado que en pacientes con TAP < 120 ms, para lograr una mejor estimación de la PMAP, la ecuación es 90 - 0,62(TAP)41. Es importante señalar que para el cálculo de la PMAP mediante el TAP, la frecuencia cardíaca debe permanecer entre 60 - 100 latidos/min, porque son inversamente proporcionales, y en presencia de taquicardia obtendríamos un TAP acortado sin un aumento real de las presiones.
Dyer et al42, en un reciente estudio con una población pediátrica, que presentaba HTP idiopática, demostraron una estrecha relación entre el índice de Tei y la PMAP (estimada por cateterismo), independientemente de la regurgitación tricuspídea, y puede ser usado en la monitorización de los pacientes después de iniciado el tratamiento médico. En un reducido grupo de pacientes con enfermedad del tejido conectivo, Vonk et al43, observaron que un índice de Tei > 0,36 del VD, combinado con valores de PSAP ≥ 35 mmHg, se correlacionaba con valores de PMAP > 25 mmHg; sin embargo, se necesitan estudios con mayor número de pacientes para validar la utilidad de este índice en la evaluación de la estimación de la PMAP44.
Fórmulas empíricas
La relación entre las presiones sistólica, diastólica y media de la arteria pulmonar ha sido demostrada de manera constante bajo muchas circunstancias y varias fórmulas empíricas. Varios estudios cruentos han sido propuestos para estimar la presiones media, sistólica y diastólica de la arteria pulmonar [PMAP = 1/3(PSAP) + 2/3(PDAP)]45-47; sin embargo, estas no han sido validadas mediante ecocardiografía48, por lo que se sugiere que la estimación incruenta de la PMAP (por ecocardiografía), sea por otras variables que aumenten la exactitud de su valor.
Presión diastólica de la arteria pulmonar (PDAP)
La aplicación de la ecuación simplificada de Bernoulli posibilita el cálculo del gradiente de presión entre el ventrículo derecho y la arteria pulmonar al final de la diástole, con este gradiente de presión, y sumando la PAD, se obtiene la presión diastólica de la arteria pulmonar con una elevada correlación, comparada con las mediciones cruentas49,50.
PDAP = 4(V)2 (velocidad final de regurgitación pulmonar) + PAD.
Por su parte, Ristow et al.51 demostraron que un aumento de más de 5 mmHg del gradiente de regurgitación pulmonar al final de la diástole, se correlacionaba con una elevación de los niveles séricos de péptido natriurético B, un aumento del índice de masa del VI y con una disfunción sistodiastólica.
Estimación de presiones ventriculares derechas en el momento de la apertura de la válvula pulmonar
Está bien demostrado que la PDAP puede ser estimada cuando se miden las presiones ventriculares derechas en el momento de la apertura valvular pulmonar (Figura 4), porque ambas presiones (ventriculares derechas y pulmonares) están balanceadas en ese momento del ciclo cardíaco52.
Como fue discutido anteriormente, el gradiente de presión entre AD y VD puede ser estimado por la VRT, por consiguiente, si se aplica la ecuación de Bernoulli, se puede calcular la PDAP53, a partir del valor de la VRT en el momento en que la válvula pulmonar comienza su apertura (Figura 4). Este método tiene gran correlación con las presiones obtenidas por cateterismo54, 55.

Figura 4. Estimación de la presión diastólica del ventrículo derecho en el momento de la apertura de la válvula pulmonar. En la imagen superior se observa el momento de la apertura valvular pulmonar y en la inferior, la VRT en ese instante.
Presión en aurícula derecha (PAD)
Vena cava inferior (VCI)
Existe estricta correlación entre la PAD con la presión venosa central (PVC), la técnica más empleada para su estimación, es mediante el diámetro y colapso de la VCI, en los diferentes momentos del ciclo respiratorio56 (Figura 5). La VCI debe ser visualizada en una vista subcostal con el paciente en decúbito supino porque los diámetros de esta, son significativamente mayores en decúbito lateral derecho y menores, en decúbito lateral izquierdo57 asimismo, la medición de estos deben ser aproximadamente a 2cm de su entrada en la AD, durante la inspiración (momento en el que disminuye su diámetro), y en la espiración (momento en el que aumenta)58. Es importante recordar que personas jóvenes pueden tener diámetros de VCI (> 2 cm) con valores de PAD normales57, y que en pacientes ventilados con presión positiva, los grados de colapso de la VCI no deben ser empleados para estimar la PAD58,59,60.
Para simplificar todos los algoritmos que existen, derivados de los diámetros y el colapso de la VCI, la Sociedad Americana de Ecocardiografía, en un artículo recientemente publicado61, recomienda lo siguiente: si el diámetro de la VCI < 21 mm y colapsa > 50 %, la PAD es de 3 mmHg (rango de 0-5mmHg), mientras que si el diámetro es > 21 mm y colapsa < 50 %, la PAD es de 15 mmHg (rango de 10 − 20 mmHg). En casos indeterminados en los que el diámetro de la VCI y su colapso no siguen este modelo, pueden ser empleados valores intermedios de PAD, de 8 mmHg (con rango de 5 - 10 mmHg), o de lo contrario se pueden usar otros índices alternativos que también permiten estimar las presiones en AD, los que serán mencionados más adelante.

Figura 5. Vista subcostal donde se aprecian los diámetros de la VCI en inspiración (izquierda) y espiración (derecha).
Indices alternativos para estimar PAD
1. Fracción de llenado sistólico (FLLS) en el flujograma de venas hepáticas
La PAD, puede ser estimada mediante el flujograma de venas hepáticas, sobre todo en pacientes ventilados (promediando las velocidades, en más de 5 respiraciones), en los que no es fiable mediante la VCI62. El flujograma normal de las venas hepáticas consiste en la presencia de una onda sistólica anterógrada (S), una diastólica anterógrada (D) y otra de flujo reverso durante la sístole auricular63,64. En un estudio realizado por Nagueh et al.65, la FLLS mostró la mejor correlación con la PAD (r = 0,86), calculada como la relación entre lTV de la onda S dividido entre la ITV onda S más la ITV de la onda D, con un valor de corte para una PAD > 8 mmHg, menor de un 55 %.
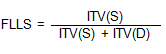
Sin embargo, en otro estudio realizado por Ommen et al.66 se demostró que la FLLS se correlacionó pobremente (r = 0,25) con la PAD, debido a que el flujo anterógrado sistólico es dependiente no solo de la PAD sino de otros factores, como la relajación y distensibilidad auricular, la presencia de regurgitación tricuspídea grave, el descenso del anillo tricuspídeo y los incrementos en la precarga de la aurícula y el ventrículo izquierdos. Este grupo de autores propusieron, para la estimación de la PAD, un nuevo método que combina la suma de la velocidad de la onda sistólica del flujograma de venas hepáticas y la del flujo reverso durante la sístole auricular, con los diámetros de la VCI:
a) SI V (onda S) + V (onda flujo reverso) <0 y VCI < 15 mm: PAD = 5 mmHg.
b) SI V (onda S) + V (onda flujo reverso) >0 y VCI > 20 mm: PAD = 25 mmHg.
c) Cualquier valor de la suma de las V, con una VCI entre 15-19: PAD = 14 mmHg.
La sensibilidad y especificidad de este método no ha sido demostrada. Otros autores67 plantean un mismo valor de corte para inferir el aumento de la PAD, al emplear la ecuación antes mencionada de la FLLS, pero con las velocidades de las ondas (S y D), también del flujograma de venas hepáticas.
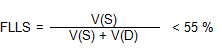
2. Tiempo de relajación isovolumétrico (TRIV) regional del VD
Abbas et al30 propusieron estimar la PAD mediante el TRIV con Doppler hístico en el anillo tricuspídeo (Figura 2); estos demostraron una relación inversa entre el TRIV y la presión de AD.
Un TRIV < 59 ms predice una PAD > 8 mmHg con una sensibilidad del 80 % y una especificidad del 87,7 %.
3. Relación E/e´ en el anillo lateral tricuspídeo
Nageh et al.68 demostraron una fuerte asociación entre la relación E/e´ y la PAD en pacientes con ventilación mecánica, con o sin disfunción sistólica del VD; una relación E/e´ > 6 tiene una sensibilidad y una especificidad para una presión de AD ≥ 10 mmHg de 79 % y 73 %, respectivamente. Los autores sugieren usar este método en pacientes en los que la vista subcostal es deficiente o en aquellos con ventilación mecánica, en los cuales el índice de VCI no es factible. Sin embargo, en un reciente estudio realizado por Michaux et al69 demostraron que la relación E/e´ para predecir la PAD en pacientes ventilados con parálisis y anestesiados, no es confiable.
Presión capilar pulmonar (PCAP)
La PCAP es un parámetro para cuantificar las presiones de llenado del ventrículo izquierdo (VI) y al mismo tiempo, ayuda a discriminar entre hipertensión arterial pulmonar e hipertensión venocapilar, secundaria a cardiopatías izquierdas2,70,71. Es importante recordar que en diversas circunstancias la PCAP no es igual a la presión diastólica final del VI, como ocurre en la estenosis mitral (valvular y supravalvular), en las obstrucciones del tracto de entrada del VI o de las venas pulmonares, en el aumento de la presión pleural, entre otras.
Está bien establecido que la velocidad de la onda E (de llenado mitral) refleja principalmente el gradiente de presión entre AI-VI durante la protodiástole, y por consiguiente, se encuentra afectada por la precarga y por las alteraciones en la relajación del VI72. La onda A mitral refleja el gradiente de presión entre estas mismas cavidades al final de la diástole, afectada por alteraciones en la adaptabilidad del VI y la contractilidad de la AI. El tiempo de desaceleración de la onda E (TD) está influenciado por la relajación del VI, la presión diastólica después de la apertura valvular mitral y su adaptabilidad. Alteraciones en los volúmenes sistólico o diastólico del VI, en su elasticidad y en las presiones diastólicas, afectan directamente las velocidades del flujo mitral (velocidad de la onda E), y los tiempos de relajación isvolumétrico (TRIV) y de desaceleración (TD)72.
Existen varias formas incruentas de estimar la PCAP [PCAP = 1.24(E/e´) + 1,9 (r=0.89)], mediante la relación E/e´, cociente E/ velocidad de propagación modo M color, tiempo de deceleración de la oda E, diferencia entre Adur-A, entre otras73,74. Los diferentes patrones de llenado y las velocidades de las ondas e intervalos, derivados del flujograma mitral (con Doppler pulsado), se correlacionan mejor con las presiones de llenado del VI, en pacientes con disminución de la función sistólica (FE < 50 %) que en aquellos con función sistólica conservada, en los que es imprescindible el uso de otras variables complementarias75-77 (Tabla 1). Debido a esto se propuso, por parte de la Sociedad Americana de Ecocardiografía, en las más recientes Guías de Recomendaciones para la evaluación de la función diastólica izquierda, un algoritmo para la estimación de las presiones de llenado del VI (Figuras 6 y 7).
Tabla 1. Valoración de las presiones de llenado en situaciones especiales

vp (venas pulmonares), fracción de llenado sistólico = ITV(S)/ITV(S)+ITV(D)
S y D (onda sistólica y diastólica del flujograma de venas pulmonares)
TD (tiempo de desaceleración

Figura 6. Algoritmo diagnóstico para la estimación de las presiones de llenado del VI con fracción de eyección deprimida.
E/Vp: Relación entre la velocidad de la onda E del flujograma mitral y la velocidad de propagación en modo M color (Vp).
S/D: Relación entre la velocidad de la onda sistólica (S) y diastólica (D) del flujograma de venas pulmonares.
Ar-A: Diferencia entre la duración de la onda A retrógrada del flujograma de venas pulmonares y la duración de la onda A del llenado mitral.
Δ E/A: Variación de la relación E/A con la maniobra de Valsalva (Vals).
TRIV/E-e´: Relación entre el tiempo de relajación isovolumétrico del VI y la diferencia de las distancias desde la E y la é hasta la onda R del electrocardiograma.
Figura 7. Algoritmo diagnóstico para la estimación de las presiones de llenado del VI con fracción de eyección conservada.
Ar-A: Diferencia entre la duración de la onda A retrógrada del flujograma de venas pulmonares y la duración de la onda A del llenado mitral.
Δ E/A: Variación de la relación E/A con la maniobra de Valsalva (Vals).
TRIV/E-e´: Relación entre el tiempo de relajación isovolumétrico del VI y la diferencia de las distancias desde la E y la é hasta la onda R del electrocardiograma.
Vol.AI: Volumen de aurícula izquierda.
Resistencia vascular pulmonar (RVP)
La evaluación de la RVP es uno de los parámetros usados para definir la hipertensión arterial pulmonar (HAP)70,78, además de ser esencial en pacientes necesitados del transplante cardíaco79. Elevados valores de RVP han sido relacionados con un aumento de la mortalidad, hospitalizaciones por insuficiencia cardíaca y sucesos cardiovasculares adversos, en pacientes con enfermedad coronaria, independientemente de los tradicionales factores de riesgo cardiovascular, fracción de eyección (FE) del VI y PSAP80. Con anterioridad algunos estudios intentaron comparar variables hemodinámicas con estimaciones de las velocidades del flujo pulmonar derivadas del Doppler, y encontraron una débil relación con la RVP81. Sin embargo, recientemente han sido validados numerosos índices para la estimación incruenta de las RVP mediante ecocardiografía. Un índice propuesto por Scapellato et al.82 requiere de la medición del período preeyectivo pulmonar (PPEP), el tiempo de aceleración pulmonar (TAP) y el tiempo sistólico total (TST); de ahí que tenga una elevada correlación con la estimación de las RVP mediante cateterismo cardíaco (r = 0,96). Un índice > 2,6 predice una RVP > 2,5 UW cuando las resistencias se encuentran entre 0-8 UW:
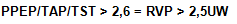
Abbas et al.83 propusieron que las RVP podían ser calculadas mediante la relación entre VRT/VTI (TSVD), y plantearon una simplificada ecuación:
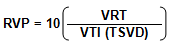
Estos autores concluyeron que los pacientes con una relación VRT/VTI (TSVD) < 0,2 tienen RVP<2UW, con una sensibilidad de un 70 % y una especificidad del 94 %, cuando, al igual que en caso anterior, las RVP se encuentren entre 0 - 8 UW.
En otras bibliografías consultadas73,74, a la ecuación propuesta por Abbas et al., le adicionan una constante, resultando entonces:

En un estudio realizado con 37 pacientes con diagnóstico de HAP84, se encontró una buena relación (r = 0,76; P < 0.0001) entre las RVP estimadas por cateterismo y la relación VRT/ITV, al utilizar la ITV del TSVD, y una relación (r = 0,74; P < 0.0001) cuando se utilizó la ITV del tracto de salida del VI (TSVI), en casos en los que la anatomía del TSVD no fue posible técnicamente mesurar. Las ecuaciones derivadas de estas progresiones lineares fueron:
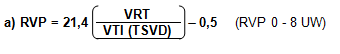
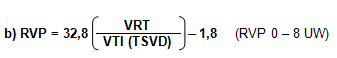
Recientemente, otro parámetro propuesto por Gurudevan et al.85, demostró una inversa relación entre las RVP y las velocidades sistólicas, evaluadas con Doppler hístico (en el anillo tricuspídeo). Una velocidad menor que 10 cm/seg se corresponde con una RVP alrededor de 12,5 UW, si se tiene en cuenta que estas velocidades no sólo se encuentran diminuidas en presencia de un aumento de las resistencias sino en otras circunstancias que involucran al VD.
HTP debido a tromboembolismo pulmonar (TEP)
TEP agudo, es la causa del aumento moderado de las presiones pulmonares y de las RVP con una PCAP, generalmente normal, en ausencia de enfermedades del hemicardio izquierdo. Dicho aumento está relacionado con el grado de obstrucción vascular. Existen varios hallazgos ecocardiográficos: el signo de McConnell86 (motilidad normal del apex del VD con disminución del movimiento de la pared libre), el signo 60/60 (TAP < 60 ms con un gradiente sistólico aurículo-ventricular derecho ≤ 60 mmHg)87, entre otros, como a) presencia de trombo en cavidades derechas, b) aumento del diámetro diastólico final del VD > 30mm en la vista paraesternal, c) relación VD − VI > 1 y d) TAP < 60 ms con gradiente de presión sistólico aurículo-ventricular derecho > 30 mmHg, en ausencia de hipertrofia ventricular izquierda; que pueden aumentar la exactitud diagnóstica del TEP por ecocardiografía.
TEP crónico: la hemodinámica en esta situación es indistinguible de la de las otras enfermedades que se acompañan de HTP, las presiones pulmonares y las RVP están marcadamente aumentadas con presencia de una PCAP, también normal89,90.
Conclusiones
El estudio hemodinámico del sistema cardiopulmonar es de gran importancia en muchas enfermedades que lo involucran directa e indirectamente. Con el paso de los años la ultrasonografía ha evolucionado y ha permitido el desarrollo de novedosas variables para la estimación incruenta de numerosos parámetros hemodinámicos, que en el pasado eran solo cuantificables por cateterismo. Precisamente, en esta revisión se reflejan una serie de índices que permiten una rápida pero exhaustiva evaluación hemodinámica con el uso de las bondades que nos brinda la ecocardiografía.
Referencias bibliográficas
Badesch DB, Champion HC, Sanchez MA, Hoeper MM, Loyd JE, Manes A, et al. Diagnosis and assessment of pulmonary arterial hypertension. J Am Coll Cardiol. 2009;54(1 Suppl):S55-66.
McGoon M, Gutterman D, Steen V, Barst R, McCrory DC, Fortin TA, et al. Screening, early detection, and diagnosis of pulmonary arterial hypertension:ACCP evidence-based clinical practice guidelines. Chest. 2004;126 (1 Suppl):14S-34S.
McLaughlin VV, Archer SL, Badesch DB, Barst RJ, Farber HW, Lindner JR, et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association. J Am Coll Cardiol. 2009;53:1573-619.
Galie N, Hoeper MM, Humbert M, Torbicki A, Vachiery JL, Barbera JA, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension.The task force for the diagnosis and treatment of pulmonary hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J. 2009;34:1219-63.
Lee KS, Abbas AE, Khandheria BK, Lester SJ. Echocardiographic assessment of right heart hemodynamic parameters. J Am Soc Echocardiogr. 2007;20(6):773-82.
Mori S, Nakatani S, Kanzaki H, Yamagata K, Take Y, Matsuura Y, et al. Patterns of the interventricular septal motion can predict conditions of patients with pulmonary hypertension. J Am Soc Echocardiogr. 2008;21(4):386-93.
Horton KD, Meece RW, Hill JC. Assessment of the right ventricle by echocardiography: a primer for cardiac sonographers. J Am Soc Echocardiogr. 2009;22:776-92.
Champion HC, Michelakis ED, Hassoun PM. Comprehensive invasive and noninvasive approach to the right ventricle-pulmonary circulation unit: state of the art and clinical and research implications. Circulation. 2009;120(11):992-1007.
Ristow B, Schiller NB. Stepping away from ritual right heart catheterization into the era of noninvasively measured pulmonary artery pressure.J Am Soc Echocardiogr 2009;22(7):820-2.
Hatle L, Angelsen BA, Tromsdal A. Non-invasive estimation of pulmonary artery systolic pressure with Doppler ultrasound. Br Heart J. 1981;45(2):157-65.
Yock PG, Popp RL. Noninvasive estimation of right ventricular systolic pressure by Doppler ultrasound in patients with tricuspid regurgitation.Circulation. 1984;70 (4):657-62.
Berger M, Haimowitz A, Van Tosh A, Berdoff RL, Goldberg E. Quantitative assessment of pulmonary hypertension in patients with tricuspid regurgitation using continuous wave Doppler ultrasound. J Am Coll Cardiol. 1985;6(2):359-65.
Currie PJ, Seward JB, Chan KL, Fyfe DA, Hagler DJ, Mair DD, et al. Continuous wave Doppler determination of right ventricular pressure: a simultaneous Doppler-catheterization study in 127 patients. J Am Coll Cardiol. 1985;6(4):750-6.
Skjaerpe T, Hatle L. Noninvasive estimation of systolic pressure in the right ventricle in patients with tricuspid regurgitation. Eur Heart J. 1986;7(8):704-10.
Fisher MR, Forfia PR, Chamera E, Housten-Harris T, Champion HC,Girgis RE, et al. Accuracy of Doppler echocardiography in the hemodynamic assessment of pulmonary hypertension. Am J Respir Crit Care Med. 2009;179(7):615-21.
Simonneau G, Robbins IM, Beghetti M, Channick RN, Delcroix M, Denton CP, et al. Updated clinical classification of pulmonary hypertension.J Am Coll Cardiol. 2009;54 (1 Suppl):S43-54.
McQuillan BM, Picard MH, Leavitt M, Weyman AE. Clinical correlates and reference intervals for pulmonary artery systolic pressure among echocardiographically normal subjects. Circulation 2001;104 (23):2797-802.
Lopes LR, Loureiro MJ, Miranda R, Almeida S, Almeida AR, Cordeiro A, Cotrim C, Carrageta M. The usefulness of contrast during exercise echocardiography for the assessment of systolic pulmonary pressure. Cardiovasc Ultrasound. 200813;6:51.
Jeon DS, Luo H, Iwami T, Miyamoto T, Brasch AV, Mirocha J, et al. The usefulness of a 10% air-10% blood-80% saline mixture for contrast echocardiography: Doppler measurement of pulmonary artery systolic pressure. J Am Coll Cardiol. 2002;39(8) (1):124-9.
Jeon DS, Luo H, Brasch AV, Nagai T, Miyamoto T, Mohsenifar Z, et al. Superiority of 10% air-10% blood-saline mixture for measuring the velocity of tricuspid regurgitation in patients with severe emphysema. J Am Soc Echocardiogr. 2003;16(8):867-70.
Tan HC, Fung KC, Kritharides L. Agitated colloid is superior to saline and equivalent to levovist in enhancing tricuspid regurgitation Doppler envelope and in the opacification of right heart chambers: a quantitative, qualitative,and cost-effectiveness study. J Am Soc Echocardiogr. 2002;15(4):309-15.
Tokushima T, Utsunomiya T, Yoshida K, Ogawa T, Kido K, Ohtsubo Y, et al. Estimation of the systolic pulmonary arterial pressure using contrast-enhanced continuous-wave Doppler in patients with trivial tricuspid regurgitation. Jpn Heart J. 1999;40 (3):311-20.
Aduen JF, Castello R, Lozano MM, Hepler GN, Keller CA, Alvarez F, et al. An alternative echocardiographic method to estimate mean pulmonary artery pressure: diagnostic and clinical implications. J Am Soc Echocardiogr. 2009;22(7):814-9.
Ristow B, Schiller NB. Stepping away from ritual right heart catheterization into the era of noninvasively measured pulmonary artery pressure. J Am Soc Echocardiogr 2009;22(7):820-2.
Beard JT, Byrd BF. Saline contrast enhancement of trivial Doppler tricuspid regurgitation signals for estimating pulmonary artery pressure. Am J Cardiol. 1988;62(7):486-8.
Bréchot N, Gambotti L, Lafitte S, Roudaut R. Usefulness of right ventricular isovolumic relaxation time in predicting systolic pulmonary artery pressure. Eur J Echocardiogr. 2008;9(4):547-54.
Lindqvist P, Waldenstrom A, Wikstrom G, Kazzam E. Right ventricular myocardial isovolumic relaxation time and pulmonary pressure: pulsed Doppler tissue imaging in resurrection of Burstin´s nomogram. Clin Physiol. 2006;26(1):1-8.
Elnoamany MF, Dawood AA. Right ventricular myocardial isovolumic relaxation time as novel method for evaluation of pulmonary hypertension:correlation with endothelin-1 levels. J Am Soc Echocardiogr. 2007;20(5):462-9.
Dambrauskaite V, Delcroix M, Claus P, Herbots L, Palecek T, D´hooge J, et al. The evaluation of pulmonary hypertension using right ventricular myocardial isovolumic relaxation time. J Am Soc Echocardiogr. 2005;18(11):1113-20.
Abbas A, Lester S, Moreno FC, Srivathsan K, Fortuin D, Appleton C. Noninvasive assessment of right atrial pressure using Doppler tissue imaging. J Am Soc Echocardiogr. 2004;17(11):1155-60.
Naeije R, Torbicki A. More on the noninvasive diagnosis of pulmonary hypertension: Doppler echocardiography revisited. Eur Respir J. 1995;8(9):1445-9.
Kitabatake A, Inoue M, Asao M, Masuyama T, Morita T, Mishima M, et al. Noninvasive evaluation of pulmonary hypertension by a pulsed Doppler technique. Circulation. 1983;68(2):302-9.
Dabestani A, Mahan G, Gardin JM, Takenaka K, Burn C, Allfie A, et al. Evaluation of pulmonary artery pressure and resistance by pulsed Doppler echocardiography. Am J Cardiol. 1987;59(6):662-8.
Lanzarini L, Fontana A, Campana C, Klersy C. Two simple echo-Doppler measurements can accurately identify pulmonary hypertension in the large majority of patients with chronic heart failure. J Heart Lung Transplant. 2005;24(6):745-54.
Kojonazarov BK, Imanov BZ, Amatov TA, Mirrakhimov MM, Naeije R, Wilkins MR, et al. Noninvasive and invasive evaluation of pulmonary arterial pressure in highlanders. Eur Respir J. 2007;29(2):352-6.
Melek M, Esen O, Esen AM, Barutcu I, Fidan F, Onrat E, et al. Tissue Doppler evaluation of tricuspid annulus for estimation of pulmonary artery pressure in patients with COPD. Lung 2006;184(3):121-31.
Masuyama T, Kodama K, Kitabatake A, Sato H, Nanto S, Inoue M. Continuous-wave Doppler echocardiographic detection of pulmonary regurgitation and its application to noninvasive estimation of pulmonary artery pressure. Circulation. 1986;74(3):484-92.
Abbas AE, Fortuin FD, Schiller NB, Appleton CP, Moreno CA, Lester SJ. Echocardiographic determination of mean pulmonary artery pressure. Am J Cardiol. 2003;92(11):1373-6.
Pyxaras SA, Pinamonti B, Barbati G, Santangelo S, Valentincic M, Cettolo F, et al. Echocardiographic evaluation of systolic and mean pulmonary artery pressure in the follow-up of patients with pulmonary hypertension. Eur J Echocardiogr. 2011;12(9):696-701.
Yock PG, Popp RL. Noninvasive estimation of right ventricular systolic pressure by Doppler ultrasound in patients with tricuspid regurgitation. Circulation. 1984;70:657-62.
Bech-Hanssen O, Lindgren F, Selimovic N, Rundqvist B. Echocardiography can identify patients with increased pulmonary vascular resistance by assessing pressure reflection in the pulmonary circulation. Circ Cardiovasc Imaging. 2010;3(4):424-32.
Dyer KL, Pauliks LB, Das B, Shandas R, Ivy D, Shaffer EM, et al. Use of myocardial performance index in pediatric patients with idiopathic pulmonary arterial hypertension. J Am Soc Echocardiogr. 2006;19(1):21-7.
Vonk MC, Sander MH, van der Hoogen FH, van Riel PL, Verheugt FW, van Dijk AP. Right ventricle Tei-index: a tool to increase the accuracy of non-invasive detection of pulmonary arterial hypertension in connective tissue diseases. Eur J Echocardiogr. 2007;8(5):317-21.
Eidem BW, O´Leary PW, Tei C, Seward JB. Usefulness of the myocardial performance index for assessing right ventricular function in congenital heart disease. Am J Cardiol. 2000;86(6):654-8.
Chemla D, Castelain V, Humbert M, Hébert J, Simonneau G, Lecarpentier Y, et al. New formula for predicting mean pulmonary artery pressure using systolic pulmonary artery pressure. Chest. 2004;126(4):1313-7.
Friedberg MK, Feinstein JA, Rosenthal DN. A novel echocardiographic Doppler method for estimation of pulmonary arterial pressures. J Am Soc Echocardiogr. 2006;19(5):559-62.
Syyed R, Reeves JT, Welsh D, Raeside D, Johnson MK, Peacock AJ. The relationship between the components of pulmonary artery pressure remains constant under all conditions in both health and disease. Chest. 2008;133(3):633-9.
Chemla D, Castelain V, Provencher S, Humbert M, Simonneau G, Hervé P. Evaluation of various empirical formulae for estimating mean pulmonary artery pressure by using systolic pulmonary artery pressure in adults. Chest. 2009;135 (3):760-8.
Lee RT, Lord CP, Plappert T, Sutton MS. Prospective Doppler echocardiographic evaluation of pulmonary artery diastolic pressure in the medical intensive care unit. Am J Cardiol. 1989;64(19):1366-70.
Ge Z, Zhang Y, Ji X, Fan D, Duran CM. Pulmonary artery diastolic pressure:a simultaneous Doppler echocardiography and catheterization study. Clin Cardiol 1992;15(11):818-24.
Ristow B, Ahmed S, Wang L, Liu H, Angeja BG, Whooley MA, et al.Pulmonary regurgitation end-diastolic gradient is a Doppler marker of cardiac status: data from the Heart and Soul Study. J Am Soc Echocardiogr. 2005;18(9):885-91..
Reynolds DW, Bartelt N, Taepke R, Bennett TD. Measurement of pulmonary artery diastolic pressure from the right ventricle. J Am Coll Cardiol. 1995;25(5):1176-82.
Stephen B, Dalal P, Berger M, Schweitzer P, Hecht S. Noninvasive estimation of pulmonary artery diastolic pressure in patients with tricuspid regurgitation by Doppler echocardiography. Chest. 1999;116(6):73-7.





