CorSalud 2009 Ene-Mar;1(2)
ARTÍCULO DE REVISIÓN
APOPTOSIS: MUERTE CELULAR PROGRAMADA. ASPECTOS GENERALES Y SU RELACIÓN CON LAS ENFERMEDADES CARDIOVASCULARES
Dra. Mirka Navas Contino1, Dra. Leydi Esther Alfonso Arbolaez2 y Dra. Isbey Guerra Rodríguez3
______________
Especialista de II Grado en Medicina General Integral. Policlínico Universitario Santa Clara. Santa Clara, Villa Clara. Asistente. ISCM-VC. Correo electrónico: bib@capiro.vcl.sld.cu
Especialista de I Grado en Medicina General Integral. Policlínico Universitario Santa Clara.Santa Clara, Villa Clara. Instructora. ISCM-VC.
Especialista de I Grado en Medicina General. Policlínico Universitario Santa Clara. Santa Clara, Villa Clara. Instructora. ISCM-VC.
Resumen
La apoptosis es una forma importante y definitiva de muerte celular, y tiene estrecha relación con las enfermedades cardiovasculares. En este trabajo hacemos una revisión del tema teniendo en cuenta no solo los antecedentes de este proceso, sino también de cuestiones generales que en él se desarrollan. Uno de los retos principales de la medicina cardiovascular para las próximas décadas es prevenir el desarrollo de insuficiencia cardíaca, para ello será preciso incrementar nuestros conocimientos sobre los mecanismos que advierten del inicio y la evolución del deterioro funcional del miocardio. La superación de estas dificultades puede hacer de la apoptosis un ejemplo paradigmático del enfoque celular-molecular que hoy en día se impone para la comprensión de las enfermedades del corazón y de los vasos sanguíneos.
Descriptores DeCS: APOPTOSIS, MUERTE CELULAR, ENFERMEDADES CARDIOVASCULARES
Apoptosis: programmed cellular death. General aspects and its relation with cardiovascular diseases
Abstract
The apoptosis is a very important and definitive form of cellular death, and has a close relation with cardiovascular diseases. A review of this topic is made in this work taking into account not only the antecedents of this process but also the general aspects involved in it. One of the main challenges for cardiovascular medicine in the next decades is to prevent the development of cardiac insufficiency. To achieve this goal it will be necessary to increase the knowledge on the mechanisms which signal the beginning and evolution of the functional deterioration of the myocardium. The overcoming of these difficulties could turn the apoptosis into a paradigmatic example of the cellular-molecular approach which nowadays is a must for the understanding of the heart and blood vessels diseases.
Subject headings: APOPTOSIS, CELL DEATH, CARDIOVASCULAR DISEASES
Antecedentes
La apoptosis es un patrón morfológico de lesión celular conocido por los anatomopatólogos desde hace tiempo, es aceptado en la actualidad como una forma importante y definitiva de muerte celular1.
Desde las primeras descripciones clásicas de Virchow se reconocía un tipo de muerte celular: la necrosis. Sin embargo, a finales del siglo pasado Walter Flemmig describió un tipo de muerte celular con características morfológicas diferentes, al que denominó cromatolisis2.
Tuvo que transcurrir casi un siglo hasta que este tipo de muerte celular fuese adecuadamente caracterizada por Kerr, quien en 1972, propuso el término de apoptosis. Se denominó de esta manera por la raíz griega apostatar, que define la caída de las hojas de los árboles en el otoño. En biomedicina se le llama así a la muerte celular programada1,2.
En los últimos 20 años, la apoptosis y la necrosis se han considerado como los tipos fundamentales de muerte celular. Sin embargo, Majno y Jaris han puesto de manifiesto la inconsistencia de este concepto. La necrosis representa el conjunto de cambios degradativos en los que culmina cualquier tipo de muerte celular. Así a la necrosis se llega tanto por un proceso de apoptosis, morfológicamente caracterizado por la unión y la fragmentación de las células, como por un proceso de oncosis, en el que la célula se hincha y se rompe. Por tanto, cabe distinguir dos tipos fundamentales de muerte celular: el apoptótico y el oncolítico1-3.
Apoptosis y necrosis
Además de presentar una apariencia morfológica distinta, ambos tipos de muerte celular tienen características diferenciales que permiten su identificación. De todas ellas la más importante es la que se refiere a las alteraciones del ADN. En todo proceso de muerte celular se produce la activación de unas enzimas, las nucleasas, que fragmentan el ADN. Mientras que en la apoptosis se activan selectivamente solo en sitios internucleosomales, en la oncosis se activan más generalizadamente endonucleasas y exonucleasas, que fragmentan el ADN tanto en sitios internucleosomales como nucleosomales4,5.
Otra diferencia fundamental entre ambos tipos de muerte celular viene dado por su utilización energética. Mientras que en el proceso de apoptosis se requiere energía para la síntesis de ARN y de proteínas, la oncosis no consume energía. Actualmente se acepta que la disponibilidad de ATP de una célula puede determinar que, ante un mismo estímulo, esta muera vía apoptosis o vía oncosis.
La apoptosis es una forma de muerte celular cuyo objetivo es el de eliminar las células que ya no son necesarias a través de la activación de una serie coordinada y programada de acontecimientos internos, que se inician por un grupo de productos génicos cuya función específica es precisamente esta5.
Situaciones en que aparece la apoptosis
Se puede observar en los siguientes contextos generales: 1) durante el desarrollo, 2) como mecanismo homeostático para el mantenimiento de las poblaciones celulares en los tejidos, 3) como mecanismo de defensa en las reacciones inmunitarias, 4) cuando las células son lesionadas por enfermedad o por agentes lesivos y 5) en el envejecimiento5,6.
Este proceso es el responsable de numerosas respuestas fisiológicas adaptativas o patológicas, entre ellas se encuentran5-7:
Destrucción programada de células durante la embriogénesis, que abarca la implantación, organogénesis, involución del desarrollo y metamorfosis. Aunque la apoptosis es un proceso morfológico que puede no siempre ser la base de la funcional y/o definida muerte celular programada de la embriogénesis, ambos términos son utilizados actualmente como sinónimo por la mayoría de los investigadores.
Involución dependiente de hormonas en el adulto, como la destrucción de células endoteliales en el ciclo menstrual, la atresia folicular del ovario en la menopausia, la regresión de la mama durante el destete y la atrofia prostática hasta la castración.
Muerte celular en las poblaciones celulares en proliferación: el epitelio de la cripta intestinal.
Muerte celular en tumores, con más frecuencia durante la regresión, pero también en tumores con crecimiento celular activo.
Muerte de los neutrófilos durante la respuesta inflamatoria aguda.
Involución y desaparición del timo.
Atrofia patológica de órganos parenquimatosos tras la obstrucción de conductos, como sucede en el páncreas, glándulas parótidas.
Lesión celular en ciertas enfermedades virales como las hepatitis.
Muerte celular producida por diversos estímulos nocivos capaces de producir necrosis, pero cuando se administran en dosis bajas pueden producir apoptosis. Ejemplo de ello es el calor, las radiaciones, los fármacos citotóxicos anticancerígenos y, posiblemente, la hipoxia.
Procesos morfológicos y bioquímicos característicos de la apoptosis4,7:
Constricción celular: la célula tiene un tamaño menor, el citoplasma es denso y los organelos, aunque relativamente normales, están muy agrupados.
Condensación de la cromatina: este es el rasgo más característico de la apoptosis. La cromatina se agrupa a la periferia, por debajo de la membrana nuclear, en masas densas bien delimitadas de diversas formas y tamaño. El núcleo puede romperse, produciendo dos o más fragmentos.
Formación de vesículas citoplasmáticas y cuerpos apoptóticos: las células apoptóticas muestran al principio una intensa vesiculación en la superficie, después sufren fragmentación en numerosos cuerpos apoptóticos rodeados de una membrana, compuestos por citoplasma y organelos muy agrupados.
Fagocitosis de las células o cuerpos apoptóticos: por las células sanas adyacentes, ya sean células parenquimatosas o macrófagos. Los cuerpos apoptóticos se degradan con rapidez dentro de los lisosomas, y las células adyacentes migran o proliferan para reemplazar el espacio ocupado por la célula apoptótica suprimida.
Este proceso, que en ocasiones no excede de 24 horas, acaba con la pérdida total de la función y la muerte. Numerosos genes poseen propiedades pro y antiapoptóticas, y pueden ser activados o inhibidos por una variedad de señales intrínsecas. En este proceso se han descrito 4 etapas:
Etapa I. Activación de las células debido a estímulos internos y externos.
Etapa II. Recepción y transducción de señales.
Etapa III o Efectora. Activación de la cisteína-proteasa (caspasa).
Etapa IV o Terminal. Fragmentación internucleosómica del ADN.
En todo este proceso las mitocondrias juegan un papel primordial. En todos los tejidos del organismo ocurre muerte celular programada, en algunas situaciones la apoptosis no es más que la contraposición de la replicación celular o mitosis. En tejidos donde la mitosis no ocurre, como el sistema nervioso central, la pérdida celular por apoptosis es una manifestación de envejecimiento8,9.
El interés que actualmente despierta el estudio de la apoptosis en medicina es grande. En efecto, la apoptosis es un proceso fisiológico que durante el período prenatal y tras el nacimiento contrarresta los efectos de la proliferación celular, contribuyendo al mantenimiento de la masa celular y la arquitectura de los órganos y los tejidos. Por lo tanto, los trastornos en la regulación de la apoptosis puede contribuir al desarrollo de diversas enfermedades. Por un lado, la apoptosis exagerada puede conducir a la atrofia y a la insuficiencia funcional de un determinado órgano, por otro, una apoptosis insuficiente de determinadas células puede participar en el desarrollo de ciertos procesos tumorales e inmunoinflamatorios10-12.
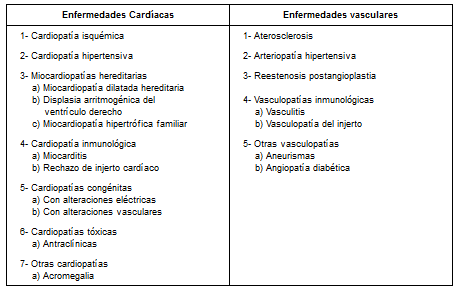
En los últimos 10 años se han publicado hallazgos que sugieren que la regulación de la apoptosis puede estar alterada en diversas enfermedades del corazón y de los vasos sanguíneos (Cuadro 1). A continuación se consideran brevemente las posibles implicaciones fisiopatológicas del exceso o el defecto de la apoptosis en las células cardíacas y vasculares en algunas enfermedades del corazón y de los vasos sanguíneos11-14.
Cuadro 1. Enfermedades donde aparece apoptosis.
Apoptosis en los cardiomiocitos
Durante el desarrollo prenatal del corazón la desaparición de células por apoptosis desempeña un papel importante en su configuración morfológica definitiva. Se ha comprobado que el índice apoptótico de los corazones neonatos es mucho mayor en el ventrículo derecho (VD) que en el izquierdo, esta diferencia es la responsable de la diferenciación de la masa contráctil de ambos ventrículos12-14.
Una cantidad importante de células de ese ventrículo mueren de manera programada después del nacimiento. Esto puede durar unos días pero en ciertas condiciones se prolonga indefinidamente y ocurre la denominada miocardiopatía de UhI, caracterizada por una dilatación extrema del ventrículo derecho, con la consecutiva insuficiencia ventricular derecha14.
Otra enfermedad relacionada con la enfermedad de UhI en la que también se ha demostrado apoptosis es la displasia arritmogénica del VD, en la que la infiltración fibrótica que sustituye el miocito apoptótico crea el sustrato para arritmias potencialmente letales15.
La displasia arritmogénica del VD es un síndrome caracterizado anatómicamente por engrosamiento y fibrosis de la pared libre de ese ventrículo, y clínicamente por taquicardia, presente generalmente en jóvenes y adultos jóvenes, frecuentemente masculinos, y en muchos casos, debida a una herencia autosómica dominante demostrada. Las arritmias ventriculares y la muerte súbita inducida por ejercicios son comunes.
Otra enfermedad donde existe muerte celular programada es la miocardiopatía dilatada, principalmente en su forma idiopática15-17.
Por otra parte, la degeneración del sistema de excitación-conducción que sufren los corazones neonatos es el resultado de procesos apoptóticos. Este proceso parece jugar un papel importante en la formación anatómica de los nodos sinusal y auriculoventricular (AV). En efecto, una buena cantidad de células P redondas u ovoides presentes en el nodo sinusal desde el nacimiento va desapareciendo poco a poco, sin que medie el menor signo inflamatorio. Algo semejante ocurre en el nodo AV18,19.
Las conexiones AV son eliminadas en el período posnatal. La persistencia de algunas de estas conexiones puede ser el origen de ciertas vías accesorias como aquellas que se encuentran en el síndrome de Wolf-Parkinson-White y en el bloqueo auriculoventricular acompañado de arritmias ventriculares19. James demostró muerte celular programada sin inflamación previa en el nodo sinusal en pacientes con síndrome de QT largo.
En el corazón adulto el papel fisiológico de la apoptosis de los cardiomiocitos está todavía sin aclarar. En la actualidad se dispone de datos que demuestran que el cardiomiocito no solo es capaz de replicarse, sino de experimentar apoptosis, lo que sugiere que, como ocurre en la mayoría de los tejidos, la apoptosis y la proliferación de los cardiomiocitos son dos procesos que se complementan para regular la celularidad del miocardio. Se ha propuesto que la pérdida de cardiomiocitos, debido a una excesiva apoptosis, podría ser un mecanismo determinante en la evolución de la disfunción ventricular a la insuficiencia cardiaca terminal en cardiopatías como la isquémica y la hipertensiva19,20.
Varios trabajos experimentales describen la aparición de apoptosis en cardiomiocitos sometidos a isquemia y/o reperfusión, se ha invocado en el precondicionamiento isquémico. Se ha demostrado que en el corazón de una rata, sometido a episodios de isquemia transitoria, las células apoptóticas disminuyen en relación con aquellos animales donde no se ha provocado precondicionamiento. Además, se ha evidenciado una exagerada apoptosis de los cardiomiocitos de pacientes con infarto agudo del miocardio e insuficiencia cardíaca. La sobrecarga mecánica y los agonistas vasoconstrictores, como la angiotensina II, inducen la apoptosis de los cardiomiocitos20-22.
Apoptosis en las células musculares lisas vasculares
La regulación de la proliferación y la muerte por apoptosis de las células musculares lisas vasculares resulta un factor importante en la configuración de la estructura normal de la pared vascular en condiciones fisiológicas. El predominio de la proliferación sobre la apoptosis se ha propuesto como el mecanismo responsable de la acumulación de las células musculares, que facilitan el engrosamiento de la capa media y de la pared de las arterias pequeñas en la hipertensión arterial, y que contribuyen a la reestenosis tras la angioplastia. Por el contrario, las células musculares lisas que han emigrado al espacio subintimal hacia una placa aterosclerótica presentan apoptosis más frecuente que las células que aún permanecen en la capa media. La exagerada apoptosis de estas células puede ser un factor determinante de la vulnerabilidad de la placa aterosclerótica, pues favorecería la disminución de la capacidad de síntesis de colágeno para reforzar la cubierta fibrosa, lo cual unido a la liberación por los macrófagos de las metaloproteinasas que degradan las fibras colágenas, daría lugar a una cápsula fibrosa más frágil22-25.
Apoptosis de las células endoteliales
La apoptosis parece ser el principal mecanismo de muerte del endotelio en condiciones fisiológicas. El equilibrio proliferación-apoptosis de las células endoteliales desempeñan un papel crítico en la formación y regresión de los vasos sanguíneos, especialmente las arteriolas y los capilares. Por ello, una excesiva apoptosis de estas células puede estar implicada tanto en la disfunción endotelial, como en la inhibición de la oncogénesis, descritas en diversas enfermedades vasculares. Este proceso puede ser especialmente relevante en la patogenia de la aterosclerosis4,11,23.
Las células endoteliales apoptóticas presentan modificaciones fenotípicas de su superficie que se traducen en un aumento en la expresión de moléculas de adhesión y de factor tisular procoagulante. Lo primero participaría en los estadios iniciales de la formación de la lesión aterosclerótica, mientras que lo segundo contribuiría a la complicación trombótica de la misma24-26.
Desarrollo futuro
La mayoría de los trabajos sobre apoptosis y enfermedades cardiovasculares se han publicado en la última década. De ello se deduce que este es un campo en el que hay mucho por investigar y desarrollar. En este sentido se pueden emitir ciertas consideraciones de posible interés fisiopatológico, diagnóstico y terapéutico27.
En el ámbito de los mecanismos de la apoptosis
Desde el punto de vista fisiopatológico, la apoptosis es un proceso defensivo de eliminación de células viejas, dañadas o infectadas. Así se ha descrito que la liberación experimental de virus en el miocardio se acompaña de la apoptosis de los cardiomiocitos infectados. En ratas se ha demostrado la presencia de material genético retroviral, relación aparente con la sobrecarga hemodinámica ventricular. También se ha detectado genoma adenoviral en el miocardio de pacientes con miocardiopatía idiopática que no presentaban signos de miocarditis activa28.
La estimulación de receptores beta (β) adrenérgicos da lugar a la apoptosis de los cardiomiocitos, mediado por la subunidad Gs alfa de las proteínas G acopladas al receptor β adrenérgico. Existe controversia sobre si la estimulación crónica de estos receptores β adrenérgicos o su desensibilización, es perjudicial en la patogenia de la insuficiencia cardíaca.
Es bien sabido que la angiotensina II estimula el crecimiento de las células cardíacas y vasculares, pero datos recientes demuestran que también puede facilitar la apoptosis de las mismas. La apoptosis de las células endoteliales y de las células musculares lisas está mediada por receptores AT2, mientras que en los cardiomiocitos sería por los receptores AT1. La comprensión del equilibrio entre las acciones procrecimiento y proapoptosis de la angiotensina II en el sistema cardiovascular es importante para entender su contribución a la reestructuración cardiovascular que se da en distintas enfermedades28,29.
Fisiológicamente, el óxido nítrico es un regulador bifuncional de la apoptosis en las células endoteliales. En condiciones fisiológicas ese efecto antiapoptótico se ejerce a través de varios mecanismos, fundamentalmente inhibiendo las caspasas mediante su S-nitrofuración. Sin embargo, en condiciones patológicas caracterizadas por producción exagerada de anión superóxido, el óxido nítrico puede ser la fuente para la formación de peroxinitritos, que inducen el proceso de apoptosis. Por lo tanto, en todo este proceso aún está por dilucidar el posible papel citotóxico del óxido nítrico en enfermedades como la aterosclerosis y la hipertensión30.
En el ámbito de la detección de la apoptosis
La detección in situ de las células apoptóticas presenta actualmente varias limitaciones, para minimizar este impacto es preciso continuar investigando y enriqueciendo nuestros conocimientos sobre los mecanismos que previenen el inicio y evolución del deterioro funcional del miocardio. Por algunas organizaciones médicas se propone como una de las líneas de investigación prioritarias de la insuficiencia cardíaca, el estudio de las alteraciones de la apoptosis28-30.
Las técnicas bioquímicas o histológicas utilizadas pueden ser insuficientes cuando se emplean aisladamente. En la actualidad se recomienda el uso combinado de varias de ellas: la electroforesis en gel para detectar la presencia de fragmentación apoptótica del ADN, que da lugar a la imagen típica en escalera; las técnicas inmunohistoquímicas destinadas a marcar los extremos de los fragmentos de ADN en las células o a identificar sustancias como la anexina en la membrana celular; y las técnicas que evalúan la expresión y la actividad de las caspasas4.
Para el diagnóstico sistémico de la apoptosis se pueden detectar en sangre ciertos marcadores del proceso apoptótico. Así, en pacientes con hipertensión arterial se han descrito alteraciones en las concentraciones sanguíneas de la proteína antiapoptótica Bcl-2, mientras que en aquellos con insuficiencia cardíaca se han descrito alteraciones de los niveles circulantes de las proteínas del sistema FAS4,7.
Aunque se trata de datos preliminares se están abriendo nuevos caminos para poder evaluar el estado proapoptótico o antiapoptótico de los pacientes. El desarrollo de marcadores específicos para estos procesos en el sistema cardiovascular es promisorio, pues se puede demostrar la apoptosis desde el punto de vista morfológico, histoquímico y bioquímico16.
Existe una serie de pacientes estudiados con insuficiencia cardíaca donde se determinaron los valores de dos protooncogenes que influyen en la apoptosis: Bcl-2 y BAX. El primero protege la célula contra la apoptosis y el segundo, la promueve. En miocitos de corazones de pacientes con insuficiencia cardíaca congestiva, el Bcl-2 promueve la supervivencia celular por la formación de heterodímeros con proteínas BAX. La formación de estos heterodímeros es modulada por tres mediadores que son Bh-1, Bh-2 y Bh-3. Si predominan homodímeros BAX, la muerte celular ocurre pero si prevalecen heterodímeros Bcl-2-BAX la célula sobrevive15,22.
La expresión de Bcl-2 en el corazón insuficiente, en ausencia de cambios en la cantidad de los niveles de BAX sugiere, que mecanismos compensatorios se han activado en el miocardio sobrecargado a fin de mantener la supervivencia celular.
Ámbito farmacológico
En distintos modelos experimentales se ha observado que algunos de los fármacos que se utilizan actualmente para el tratamiento de las enfermedades cardiovasculares modifican la apoptosis18.
Los inhibidores de la enzima conversora de angiotensina y los antagonistas de los receptores AT1 de la angiotensina previenen la apoptosis de los cardiomiocitos en la cardiopatía hipertensiva. Los β bloqueantes protegen a los cardiomiocitos de la apoptosis en condiciones de isquemia/reperfusión. Los antagonistas del calcio podrían prevenir la evolución de las lesiones ateroscleróticas impidiendo la apoptosis de las células vasculares. El papel de los inhibidores de la enzima hidroximetilglutaril coenzima A reductasa es más controvertido, pues mientras los compuestos lipofílicos (atorvastatina, sinvastatina, lovastatina) estimulan la apoptosis de las células musculares lisas vasculares, los compuestos hidrofílicos (pravastatina) no la modifican.
La modulación de la apoptosis basada en el diseño de nuevas estrategias farmacológicas empieza a emerger como un área terapéutica prometedora18,22.
En experimentos efectuados en ratas sometidos a isquemia/reperfusión miocárdica se ha observado que la transfusión previa del gen antiapoptótico Bcl-2 cursaba con menor apoptosis de los cardiomiocitos, menor liberación de enzimas cardiomiocíticas a la sangre y menor compromiso de la función miocárdica en las ratas no transfundidas. En un modelo similar de daño isquémico miocárdico se ha demostrado que un inhibidor de las caspasas, el 2VAD-FMK, disminuye la apoptosis de los cardiomiocitos y reduce el área de infarto con respecto a los animales no tratados. En animales tratados con el factor de crecimiento similar a la insulina tipo I, por vía sistémica o mediante transfusión, se constató una menor aparición de apoptosis miocárdica tras la inducción del infarto que en los animales no tratados. Además, los animales que recibieron el factor de crecimiento presentaron una menor reestructuración de la pared ventricular y menor compromiso de la función ventricular que los animales sin tratar. Aunque todavía no está suficientemente aclarado el mecanismo del efecto antiapoptótico del factor de crecimiento, algunos datos sugieren que podría estar relacionada con la inducción de alguna proteína antiapoptótica de la familia Bcl-2 y/o con la inhibición de las caspasas efectoras de la destrucción celular22,29,30.
Comentario
Uno de los retos principales de la medicina cardiovascular para las próximas décadas es prevenir el desarrollo de la insuficiencias cerebral, cardíaca, renal y circulatoria periférica, que pueden desarrollar los pacientes con enfermedades cardiovasculares. En el caso de la insuficiencia cardíaca, existen abundantes indicios de que su magnitud epidemiológica le va a conferir el carácter de una verdadera epidemia en los años venideros y para minimizar su impacto, será preciso incrementar nuestros conocimientos sobre los mecanismos que previenen el inicio y la evolución del deterioro funcional del miocardio24,27.
En este sentido, el National Heart, Lung and Blood Institute en su último informe Special Emphasis Panel in Heart Failure Research, proponía como una de las líneas de investigación prioritarias de la insuficiencia cardíaca, el estudio de las alteraciones de la apoptosis a la progresiva pérdida del músculo cardíaco y a la modificación estructural y funcional del músculo residual28.
Justo es reconocer que en el campo de la apoptosis del sistema cardiovascular se presentan aún muchas limitaciones. Algunos hacen referencia a lo fragmentario de los datos disponibles, otros a la dificultad de valorar con precisión la ocurrencia del proceso apoptótico de los tejidos, y finalmente, algunos se refieren al escaso conocimiento de los mecanismos que gobiernan la apoptosis en condiciones normales y patológicas.
La superación de estas dificultades puede hacer de la apoptosis un ejemplo paradigmático del enfoque celular-molecular que hoy en día se impone para la comprensión de las enfermedades del corazón y de los vasos sanguíneos4,30.
Referencias bibliográficas
Majno G, Jorris I. Apoptosis, oncosis and necrosis. Am J Pathol. 1995;146:3-15.
Hetts SW. To die or not to die: an overview of apoptosis and its role disease. JAMA 1998;279:300-7.
Buja LM, Entman ML. Modes of myocardial cell injury and cell death in inschemic heart disease. Circulation. 1998;98:1355-7.
Diez J. Apoptosis en enfermedades cardiovasculares. Rev Esp Cardiol. 2000;53(2): 267-74.
Itoh G, Tamura J, Suzuki M, Suzuki Y, Ikeda H, Koike M, et al. DNA fragmentation of human infarted myocardial cells demonstrated by the nick end labeling method and DNA agarose gel electroforesis. Am J Pathol. 1995;146:1325-1331.
Kajstura J. Apoptotic and necrotic myocyte cell deaths are independent contributing variables of infarct size in cats. Lab Invest. 1996;74:86.
McCarthy NJ, Evan GI. Methods for detecting and quantifying apoptosis. Curr Top Dev Biol. 1998;36:259.
Nagata S. Apoptosis by death factor. Cell. 1997;88:355.
Schoen FJ. El corazón. En: Cotran RS, Kumar V, Collins T, editors. Patología estructural y funcional. 6ta ed. Madrid: McGraw-Hill-Interamericana; 2000. p. 571-629.
Hernández Cañero A, García Barreto D. La apoptosis y el sistema cardiovascular. Rev Cub Cardiol Cir Cardiovasc. 1998;24(1):36-40.
James TN, ST Martín E, Willis PW. Apoptosis as posible cause of gradual development of complete heart block and fatal arrythmias asosiated with absence of the AV node, sinus node and internodal pathways. Circulation. 2006;93:1424-38.
Geng YJ, Lobby P. Evidence for apoptosis in advanced human atheroma. Colocalization with interleukin -1b- converting enzyme. Am J Pathol. 2005;147:251-66.
Beaumont J, Arias T, López B, González A, Ravassa S, Hermida N, et al. Avances en cardiopatía hipertensiva. Mecanismos de remodelado implicados en la transición de la hipertrofia a la insuficiencia cardiaca. Rev Esp Cardiol. 2007;7(Supl F):14-21.
González A, Fortuño MA, Querejeta R, Ravassa S, López B, López N, et al. Cardiomyocyte apoptosis in hypertensive cardiomyopathy. Cardiovas Res. 2003;59(3):549-62.
González A, López B, Ravassa S, Querejeta R, Larman M, Díez J, et al. Stimulation of cardiac apoptosis in essential hypertension. Potential role of angiotensin II. Hypertension. 2002;39:75-80.
Malmberg M, Vähäsilta T, Saraste A, Kytö V, Kiss J, Kentala E, et al. Cardiomyocyte apoptosis and duration of aortic clamping in pig model of open heart surgery. Eur J Cardiothorac Surg. 2006;30:480-4.
Fortuño MA, González A, Ravassa S, López B, Díez J. Clinical implications of apoptosis in hypertensive heart disease. Am J Physiol Heart Circ Physiol. 2003;284: H1495-H1506.
Sarkissian SD, Marchand EL, Duguay D, Hamet P, de Blois D. Reversal of interstitial fibroblast hyperplasia via apoptosis in hypertensive rat heart with valsartan or enalapril. Cardiovascular Research. 2003;57(3):775-83.
Suzuki J, Bayna E, Molle ED, Lew WYW. Nicotine inhibits cardiac apoptosis induced by lipopolysaccharide in rats. J Am Coll Cardiol. 2003;41:482-8.
Garciarena CD, Caldiz CI, Portiansky EL, Chiappe de Cingolani GE, Ennis IL. Chronic NHE-1 blockade induces an antiapoptotic effect in the hypertrophied heart. J Appl Physiol. 2009;106:1325-31.
Beaumont J, Arias T, Ravassa S, Díez J. Overexpression of human truncated peroxisome proliferator-activated receptor {alpha}induces apoptosis in HL-1 cardiomyocytes. Cardiovascular Research. 2008;79(3):458-63.
Mayorga M, Bahi N, Ballester M, Comella JX, Sanchis D. Bcl-2 Is a key factor for cardiac fibroblast resistance to programmed cell death. J Biol Chem. 2004;279(33): 34882-9.
Lee SD, Chu CH, Huang EJ, Lu MC, Liu JY, Liu CJ, et al. Roles of insulin-like growth factor II in cardiomyoblast apoptosis and in hypertensive rat heart with abdominal aorta ligation. Am J Physiol Endocrinol Metab. 2006;291:E306-E314.
Lee SD, Kuo WW, Bau DT, Ko FY, Wu FL, Kuo CH, et al. The coexistence of nocturnal sustained hypoxia and obesity additively increases cardiac apoptosis. J Appl Physiol. 2008;104:144-53.
Peterson JM, Bryner RW, Sindler A, Frisbee JC, Alway SE. Mitochondrial apoptotic signaling is elevated in cardiac but not skeletal muscle in the obese Zucker rat and is reduced with aerobic exercise. J Appl Physiol. 2008;105(6):1934-43.
Londoño D, Bai Y, Zückert WR, Gelderblom H, Cadavid D.Cardiac Apoptosis in severe relapsing fever borreliosis. Infect Immun. 2005;73(11):7669-76.
Domínguez-Hernández MA, Hernández Cañaveral II, Sánchez Enríquez S, González Hita M, Galindo Barajas JR, Michel JB. Apoptosis y endotelio vascular en un modelo experimental de endocarditis. Rev Fac Med UNAM. 2009;52(2):59-62.
Hunter AL, Choy JC, Granville DJ. Detection of apoptosis in cardiovascular diseases. Methods Mol Med. 2005;112:277-89.
Ravassa Albéniz S, González Miqueo A, López Salazar B, Zudaire Goldaracena A, Cachofeiro V, Lahera Corteza V, et al. La aldosterona incrementa la expresión de anexina A5 y la apoptosis en el miocardio. Papel mediador de la anexina A5 en la apoptosis inducida por aldosterona. Rev Esp Cardiol. 2008;61(Sup 3):1-207.
Arias Guedón T, Beaumont J, Ravassa Albéniz S, Díez Martínez J. La sobreexpresión de PPAR alfa truncado humano induce la apoptosis de los cardiomiocitos HL-1. Rev Esp Cardiol. 2008;61(Sup 3):1-207.
Recibido: 08 de junio de 2008
Aceptado: 19 de diciembre de 2008
Subir






















