CorSalud 2011;3(4)
CASO CLÍNICO
RELEVANCIA DEL
DIAGNÓSTICO DIFERENCIAL ENTRE EL SÍNDROME AÓRTICO AGUDO Y EL SÍNDROME CORONARIO
AGUDO EN PACIENTES CON DOLOR TORÁCICO Y CRISIS HIPERTENSIVA: REVISIÓN A
PROPÓSITO DE 2 CASOS
Por:
Dr. Jose
Antonio Linares Vicente, Dr. Borja Simó
Sánchez, Dra. María Pilar Portero Pérez y Dr. José Ramón Ruiz Arroyo.
Sección de Cardiología Intervencionista y Hemodinámica. Servicio de
Cardiología. Hospital Clínico Universitario Lozano Blesa.
Zaragoza. España.
Resumen
El síndrome aórtico agudo es un proceso
patológico de baja incidencia en comparación con el síndrome coronario agudo,
aunque con peor pronóstico a corto plazo, razón por la cual su diagnóstico
precoz y tratamiento urgente son esenciales para la evolución favorable del
paciente.
Las alteraciones electrocardiográficas
sugestivas de isquemia miocárdica, de evolución aguda, son poco frecuentes en
el síndrome aórtico agudo, aunque en presencia de un dolor torácico sugestivo y
cifras elevadas de presión arterial, un adecuado diagnóstico diferencial cobra
suma importancia, ya que la administración de anticoagulación
y antiagregación a altas dosis puede tener un impacto
dramático en la evolución del paciente. Se presentan 2 casos clínicos en los
que las alteraciones electrocardiográficas determinaron la conducta a seguir en
pacientes con síndrome aórtico agudo.
Abstract
Acute aortic
syndrome is a pathological process with low incidence compared with acute
coronary syndrome, although with a worse prognosis in the short term, which is
why its early diagnosis and urgent treatment are essential to the favorable evolution of the patient.
Electrocardiographic
changes suggestive of myocardial ischemia, with acute evolution, are rare in
acute aortic syndrome. Even in the presence of a suggestive thoracic pain and
high levels of blood pressure, an adequate differential diagnosis is of utmost
importance, since the administration of anticoagulation and antiplatelet
therapy in high doses can have a dramatic impact on patient outcome. Two cases
are presented in which electrocardiographic changes
determined the action to take in patients with acute aortic syndrome.
|
Palabras clave: SÍNDROME AÓRTICO AGUDO SÍNDROME CORONARIO AGUDO HIPERTENSIÓN MALIGNA |
Key words: ACUTE AORTIC SYNDROME ACUTE CORONARY SYNDROME HYPERTENSION, MALIGNANT |
Introducción
A pesar de tener una similar presentación
clínica, el síndrome aórtico agudo es un proceso patológico de baja incidencia
en comparación con el síndrome coronario agudo, aunque con peor pronóstico a
corto plazo, razón por la cual su diagnóstico precoz y tratamiento urgente son
esenciales para la evolución favorable del paciente.
Las alteraciones electrocardiográficas
sugestivas de isquemia miocárdica, de evolución aguda, son poco frecuentes en
el síndrome aórtico agudo, aunque en presencia de un dolor torácico sugestivo y
cifras elevadas de presión arterial, un adecuado diagnóstico diferencial cobra
suma importancia, ya que la administración de anticoagulación
y antiagregación a altas dosis puede tener un impacto
dramático en la evolución del paciente. Se presentan 2 casos clínicos en los
que las alteraciones electrocardiográficas determinaron la conducta a seguir en
pacientes con síndrome aórtico agudo.
CASO 1
Hombre de 74 años, con antecedentes
personales de hipertensión arterial (HTA) y tratamiento con diltiazem,
que presenta fibrilación auricular crónica y para ello tiene terapia antitrombótica con acenocumarol.
Acude al Servicio de Urgencias refiriendo, desde hacía varias horas, dolor centrotorácico de aparición brusca y en reposo, irradiado a
espalda y hombros, acompañado de sudoración fría profusa, y cifras de presión
arterial elevadas (170/120 mmHg). No presentaba signos
de focalización neurológica. En el electrocardiograma (ECG) se apreciaba
fibrilación auricular con respuesta ventricular media de alrededor de 90
latidos por minuto e infradesnivelación del segmento
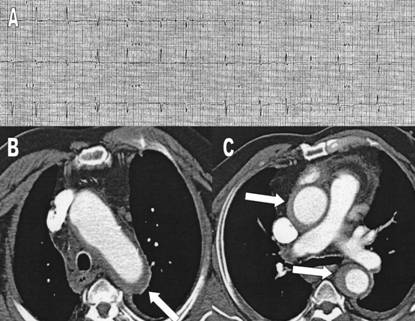
ST, y onda T negativa de V3 a V6 (figura 1A). La radiografía
de tórax mostraba ensanchamiento mediastínico. El
dolor no mejoraba claramente con la administración de nitritos sublinguales,
aunque sí cedía con metamizol y tramadol
intravenosos.
La seriación de enzimas de necrosis
miocárdica fue negativa, aunque dada la tipicidad del dolor y los hallazgos
electrocardiográficos previamente desconocidos, se decidió ingreso hospitalario
con el diagnóstico de síndrome coronario agudo sin elevación del segmento ST
(SCASEST), y se administró aspirina y clopidogrel. En
los estudios de laboratorio, al ingreso, destacaban una anemia normocítica leve (hemoglobina: 12 gr/dl), actividad de protrombina en
el límite inferior de la normalidad (44 %, INR: 2) y un dímero D discretamente
elevado (914 ng/ml). La ecocardiografía
mostraba un ventrículo izquierdo hipertrófico, con función sistólica
conservada, sin alteraciones segmentarias de la
contractilidad y sin trastornos valvulares.
Durante las primeras horas de ingreso
el paciente presentó varios episodios de dolor torácico de similares
características al que había motivado el ingreso, con cifras elevadas y
fluctuantes de la presión arterial (de hasta 220/120 mmHg),
a pesar del tratamiento antihipertensivo con enalapril,
diltiazem y torasemida.
Ante la sospecha clínica y radiológica de síndrome aórtico agudo se solicitó
una tomografía axial computarizada (TAC) urgente, que evidenció un hematoma
aórtico desde la aorta ascendente hasta la descendente (después del origen de
la subclavia izquierda), que involucraba el cayado aórtico, contenido en un engrosamiento
fibroso de la serosa (figuras 1B y
|
|
|
Figura 1. ECG con descenso del segmento ST y
onda T negativa de V3-V6 (A), y TAC, con evidencia de
un hematoma aórtico que involucra al cayado (B) y las aortas ascendente y
descendente (C, flechas blancas). |
El caso fue valorado por el Servicio de
Cirugía Cardíaca, el cual desestimó la intervención
quirúrgica, debido al amplio trayecto aórtico afectado por el hematoma y las
elevadas morbilidad y mortalidad asociadas a la cirugía de recambio de arco
aórtico. El paciente fue trasladado a
Los episodios de dolor torácico
cedieron durante las siguientes 48 horas. Una nueva TAC a las 72 horas,
descartó la progresión anatómica del hematoma. Durante el ingreso no se apreció
descenso en las cifras de hemoglobina o hematócrito.
El paciente pudo ser egresado del hospital tras sustituir la medicación
intravenosa por atenolol, enalapril,
y torasemida, y retirar el tratamiento con acenocumarol.
Al mes de seguimiento se realizó una coronariografía que confirmó la ausencia de lesiones
coronarias significativas. Cuatro meses después del proceso agudo, el paciente
permanece asintomático, en clase funcional I de
Discusión
El hematoma intramural
aórtico representa alrededor del 5 % de los casos de síndrome aórtico agudo1,2.
Se trata de una hemorragia contenida dentro de la capa media de la pared
aórtica, y aunque su patogenia es dudosa, se postula que el fenómeno inicial es
una ruptura de los vasa vasorum de la media externa, que se extiende hacia la
adventicia. Se distingue de la disección aórtica típica por la ausencia de
desgarro de la íntima o comunicación directa entre la capa media y la luz
aórtica3.
Paralelamente a nuestro caso, la
mayoría de los pacientes afectados presentan edad avanzada y antecedentes de HTA4, y durante la fase aguda
presentan un dolor centrotorácico irradiado a hombros,
con cifras elevadas de presión arterial o labilidad de esta5. El hematoma intramural no
se acompaña de alteraciones del ritmo ni electrocardiográficas significativas,
salvo que involucre el ostium
de salida de las arterias coronarias6,
por lo que las alteraciones de la repolarización presentes
en el ECG de nuestro paciente se podrían atribuir a una sobrecarga crónica de
presión e hipertrofia ventricular izquierda, debido a
La técnica más sensible y específica
para su diagnóstico es
La evolución natural del hematoma intramural aórtico no es bien conocida8, aunque en este caso el tratamiento anticoagulante y antiagregante intensivo administrado, dada la confusión
diagnóstica planteada por el ECG, pudo haber magnificado una hemorragia,
originalmente, de menor cuantía y extensión, que la observada. La afectación de
la aorta ascendente confiere una alta mortalidad a corto plazo (hasta del 80 %
a los 30 días)5, y hasta
en un 16 % de los pacientes puede degenerar en disección aórtica manifiesta,
incluso meses después de la presentación inicial7,8, por lo que el tratamiento
quirúrgico es de primera elección en estos casos.
Los hematomas intramurales
pueden mostrar su regresión con el tiempo, o incluso resolverse por completo en
el seguimiento1, por lo
que el tratamiento médico basado en el control estricto de las cifras de
presión arterial puede ser una opción terapéutica aceptable5. A diferencia de lo recomendado para los casos de
disección aórtica, en donde los betabloqueantes son
el fármaco de elección para el control de la presión arterial; en el hematoma
aórtico no existe ningún dato sobre el grupo farmacológico más adecuado para
conseguir este objetivo. Tampoco existen datos que correlacionen categóricamente
la regresión del hematoma mural con un control más estricto de la presión
arterial, aunque los datos morfológicos obtenidos por las diferentes técnicas
de imagen en el seguimiento sugieren esta evolución9.
Tal y como ocurría en el caso de
nuestro paciente, debido a su fibrilación auricular crónica, el hematoma
aórtico se puede asociar a la necesidad de un tratamiento crónico con anticogulantes orales. A pesar de que no existe evidencia
científica para interrumpir el tratamiento anticoagulante, este hecho es una
práctica común ante esta enfermedad. Sin embargo, hay descritas pequeñas series
de pacientes en donde se ha demostrado que el tratamiento anticoagulante no
presenta ningún impacto en la evolución clínica o morfológica de los hematomas
intramurales10.
CASO
2
Hombre de 77 años, con antecedentes
personales de HTA y tratamiento con enalapril. Es
valorado en su domicilio por presentar dolor centrotorácico
súbito en reposo, irradiado a ambos brazos, de 60 minutos de duración, con
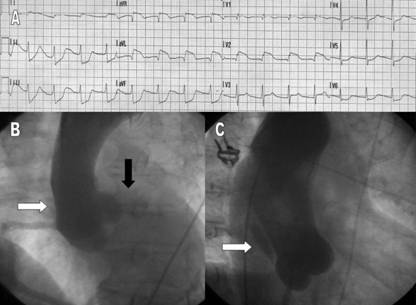
importante cortejo vegetativo y cifras elevadas de presión arterial (190/100 mmHg). El ECG mostraba bradicardia sinusal e imagen de
lesión subepicárdica y ascenso del segmento ST de
hasta
La evolución fue desfavorable y el
paciente presentó infarto agudo de miocardio Killip
IV, con persistencia de la imagen de lesión subepicárdica
y aparición de onda Q en V1-V3, DI y aVL, pasados 90 minutos de la administración de la terapia fibrinolítica (Fig. 1); y desarrollo de shock* cardiogénico con hipotensión arterial
franca (70/30 mmHg), que precisó de la administración
de fármacos vasoactivos (dopamina y dobutamina) e intubación orotraqueal
y ventilación mecánica. El ecocardiograma transtorácico
evidenciaba hipocinesia marcada y extensa ántero-lateral, con una función sistólica extremadamente
disminuida sin apreciarse imagen de derrame pericárdico. Se solicitó coronariografía de rescate urgente al centro de referencia
con disponibilidad de sala de hemodinámica: la arteria coronaria derecha era
dominante sin lesiones angiográficas significativas, no
se consiguió cateterizar la coronaria izquierda, y la inyección de contraste en
el bulbo aórtico mostró retención de este, sugestivo de disección aórtica, por
lo que se realizó una aortografía suprasigmoidea
que puso de manifiesto el diagnóstico de disección a nivel de la raíz aórtica (Fig.
2B y 2C, flechas blancas), que involucraba el ostium de la arteria coronaria
izquierda, sin posibilidad de visualización ni cateterización
de esta (flecha negra).
|
|
|
Figura 2. ECG con lesión subepicárdica
ántero-lateral extensa (A) y aortografía
en 2 proyecciones, que evidencia la disección aórtica (B y C, flechas
blancas), sin visualizarse subselectivamente la
coronaria izquierda (flecha negra). |
Se comentó el caso con el equipo de
Cirugía Cardíaca, y se desestimó la intervención
quirúrgica, debido a la alta mortalidad relacionada con la situación
hemodinámica del paciente.
Su evolución fue desfavorable a pesar
del soporte ionotrópico, y se mantuvo el síndrome de shock cardiogénico por disfunción sistólica a pesar del soporte farmacológico,
con gran elevación de marcadores de necrosis miocárdica (creatinfosfokinasa:
8248 UI/L), desarrollo de acidosis metabólica, oligoanuria
mantenida sin respuesta al tratamiento diurético e hipoxemia
progresiva, a pesar de la optimización de los parámetros de ventilación
mecánica. En ningún momento se apreció derrame pericárdico significativo con
repercusión hemodinámica. No se evidenció clínica neurológica compatible con
progresión ascendente de la disección aórtica. El paciente falleció debido a
disociación electromecánica en las primeras 24 horas tras el ingreso en el
centro hospitalario.
Discusión
La disección aórtica es una enfermedad
perteneciente al espectro del síndrome aórtico agudo1. Es una afección poco frecuente (3 casos por 100.000
personas al año)11,
aunque con una elevada mortalidad a corto plazo en ausencia de tratamiento12. Tal y como ocurría en el
caso de nuestro paciente, la incidencia máxima de esta enfermedad se produce en
la séptima década de la vida, donde el antecedente de HTA se manifiesta en el
80 % de los casos, por lo que el control de este factor de riesgo
cardiovascular es el elemento más importante para evitar su aparición13.
La disección de la aorta comienza por
un despegamiento de la íntima que facilita la penetración de la sangre hacia la
capa media, dividiéndola en 2 planos de forma anterógrada
y retrógrada. El espacio lleno de sangre se denomina falsa luz, y puede
distenderse progresivamente hasta limitar el espacio de la luz verdadera, que
se manifiesta como HTA y dolor torácico súbito, típicamente irradiado a ambos
brazos14.
La localización de la disección es de
suma importancia, ya que determina los síntomas acompañantes en dependencia de
su progresión, así como su pronóstico. La disección de la aorta ascendente
(tipo A de Stanford) es con frecuencia letal, y tiene
una mortalidad de 2 % por hora desde el inicio de los síntomas18, razón por la que se
considera la intervención quirúrgica con reemplazo protésico del arco aórtico
como la primera opción de tratamiento19.
El riesgo de muerte aumenta en dependencia de la progresión anterógrada
(afectación de troncos supraaórticos e hipoperfusión cerebral)20 o retrógrada, lo
que puede ocasionar un taponamiento cardíaco por derrame pericárdico masivo o una
regurgitación aórtica aguda grave por dilatación de la unión sinotubular y prolapso de los velos aórticos21. En ciertas ocasiones,
tal y como sucedió en el caso clínico que presentamos, la progresión retrógrada
de la disección puede involucrar el ostium de las arterias coronarias, y causar un infarto agudo
de miocardio con alteraciones electrocardiográficas como las que presentamos,
aunque a diferencia de este paciente, en donde se involucraba el ostium de la
coronaria izquierda, en la mayoría de los casos el involucrado es el de la
coronaria derecha, que simula un infarto de miocardio inferior22. En estas situaciones el
intervencionismo coronario está condicionado e impedido por la dificultad de
avanzar guías de angioplastia a través de la luz
verdadera virtualmente colapsada23,
aunque en la bibliografía podemos encontrar algún caso con resultado
satisfactorio24. Tal y
como ocurrió en el nuestro, el uso de tratamiento trombolítico
debido al diagnóstico erróneo, se ha asociado con un empeoramiento del
pronóstico y un aumento de la mortalidad a corto plazo25, en el que esta conducta terapéutica pudo ser decisiva
para su fatal desenlace.
*SHOCK: Este término está descrito fisiopatológicamente en el DRAE con aceptable precisión. Shock debe decirse choque aunque en este caso lo aceptamos
para evitar posibles ambigŁedades.
Referencias bibliográficas
1.
Laymen M,
Fein SA. Acute aortic syndromes. Emerg Med.
1999;31:87-91.
2. Evangelista A,
Domínguez R, Sebastiá C, Salas A, Permanyer-Miralda G, Avegliano G, et al. Prognostic
value of clinical and morphologic findings in short-term evolution of aortic
intramural haematoma. Therapeutic implications. Eur
Heart J. 2004;25(1):81-7.
3. Lui RC, Menkis
AH, McKenzie FN. Aortic dissection without intimal
rupture: diagnosis and management. Ann Thorac Surg. 1992;53(5):886-8.
4.
Robbins RC, McManus RP, Mitchell RS,
Latter DR, Moon MR, Olinger GN, et al. Management of patients with intramural hematoma of the thoracic aorta. Circulation. 1993;88(
5.
Nienaber
CA, Von Kodolitsch Y, Petersen B, Loose R, Helmchen U, Haverich A, et al. Intramural hemorrhage
of the thoracic aorta: diagnostic and therapeutic implications. Circulation. 1995;92(6):1465-72.
6.
Marti V, Paniagua
P, Ginel A. Severe coronary luminal narrowing
ascribed to aortic intramural haematoma after valve surgery. Heart. 2007;93(11):1405.
7. Vilacosta I, San Román JA, Ferreirós J, Aragoncillo P,
Méndez R, Castillo JA, et al. Natural
history and serial morphology of aortic intramural hematoma:
a novel variant of aortic dissection. Am Heart J. 1997;134(3):495-507.
8.
Evangelista A, Mukherjee
D, Mehta RH, O'Gara PT, Fattori R, Cooper JV, et al; International Registry of Aortic
Dissection (IRAD) Investigators. Acute intramural hematoma
of the aorta: a mystery in evolution. Circulation. 2005;111(8):1063-70.
9.
Evangelista A, Domínguez R, Sebastia
C, Salas A, Permanyer-Miralda G, Avegliano
G, et al. Long-term
follow-up of aortic intramural hematoma: predictors
of outcome. Circulation. 2003;108(5):583-9.
10.
Cañadas MV, Vilacosta
I, Ferreirós J, Bustos A, Díaz-Mediavilla J, Rodríguez E. Intramural
Aortic Hematoma and Anticoagulation. Rev Esp Cardiol. 2007;60:201-4.
11.
Meszaros I, Morocz
J, Szlavi J, Schmidt J, Tornoci L, Nagy L, et al. Epidemiology
and clinicopathology of aortic dissection.
Chest. 2000;117:1271-8.
12.
Hirst
AE, Johns VJ, Kime SW. Dissecting aneurysm of the
aorta: a review of 505 cases. Medicine. 1958;37(3):217-79.
13.
Hagan PG, Nienaber
CA, Isselbacher EM, Bruckman
D, Karavite DJ, Russman PL,
et al. The
International Registry of Acute Aortic Dissection (IRAD): new insights into an
old disease. JAMA. 2000;283(7):897-903.
14.
Roberts CS, Roberts WC. Aortic
dissection with the entrance tear in the descending thoracic aorta: analysis of 40 necropsy patients. Ann Surg.
1991;213:356-68.
15.
Nienaber CA, von Kodolitsch Y, Nicolas V, Siglow V, Piepho A, Brockhoff C, et al. The
diagnosis of thoracic aortic dissection by non-invasive imaging procedures. N Engl J Med. 1993;328(1):1-9.
16. Bansal RC, Chandrasekaran
K, Ayala K, Smith D. Frequency and explanation of false negative diagnosis of
aortic dissection by aortography and transesophageal echocardiography. J Am Coll
Cardiol. 1995;25(6):1393-401.
17.
Suzuki T, Distante A, Zizza A, Trimarchi S, Villani M, Salerno Uriarte JA, et al;
IRAD-Bio Investigators. Diagnosis
of acute aortic dissection by D-dimer: the
International Registry of Acute Aortic Dissection Substudy
on Biomarkers (IRAD-Bio) experience. Circulation. 2009;119(20):2702-7.
18. Tsai
TT, Evangelista A, Nienaber CA, Trimarchi
S, Sechtem U, Fattori R, Myrmel T, Pape L, Cooper JV,
Smith DE, Fang J, Isselbacher E, Eagle KA;
International Registry of Acute Aortic Dissection (IRAD). Long-term survival in
patients presenting with type A acute aortic
dissection: insights from the International Registry of Acute Aortic Dissection
(IRAD). Circulation. 2006;114(1 Suppl):I350-6.
19. Erbel R, Alfonso F, Boileau C, Dirsch O, Eber B, Haverich A, et al. Diagnosis and management of
aortic dissection. Eur Heart J. 2001;22(18):1642-81.
20. Nallamothu BK, Mehta
RH, Saint S, Llovet A, Bossone
E, Cooper JV, et al. Syncope in acute
aortic dissection: diagnostic, prognostic, and clinical implications. Am J Med.
2002;113:468-71.
21. Mehta
RH, Suzuki T, Hagan PG, Bossone E, Gilon D, Llovet A, et al. Predicting death in patients with
acute type A aortic dissection. Circulation. 2002;105:200-6.
22. Spittell PC, Spittell JA, Joyce JW, Tajik AJ, Edwards WD, Schaff HV, et al.
Clinical features and differential diagnosis of aortic dissection. Mayo Clin Proc. 1993;68(7):642-51.
23. Courand PY, Dauphin
R, Roussel E, Besnard C, Lantelme P. An uncommon presentation of acute type A aortic dissection: left main coronary artery obstruction. J Cardiovasc Med (Hagerstown). 2011
Jun 10. 10 [Epub ahead of print] doi:
10.2459/JCM.0b013e328348c390.
24. Ravandi A, Penny
WF. Percutaneous intervention of an acute left main
coronary occlusion due to dissection of the aortic root. JACC Cardiovasc Interv. 2011 Jun;4(6):713-5.
25. Kamp TJ, Goldschmidt-Clermont PJ,
Brinker JA, Resar JR.
Myocardial infarction, aortic dissection and thrombolytic
therapy. Am Heart J. 1994;128(6 Pt 1):1234-7.
Recibido: 05 de julio de 2011
Aceptado para su publicación: 12 de agosto de 2011