CorSalud
2011;3(3)
CASOS CLÍNICOS
CONDUCCIÓN
ANESTÉSICA DE
Por:
MSc.Dr.
Antonio de Arazoza Hernández1, Dr. Fausto Leonel Rodríguez Salgueiro2,
Dr. Amaury Fernández Molina3, Dr. Miguel Ángel Carrasco Molina4,
Dra. Elizabeth Rodríguez Rosales5 y Téc. Odalys Ojeda Mollinedo6
______________
1.
Máster en Urgencias y Emergencias Médicas. Especialista
de I Grado en Medicina General Integral y en Anestesiología y Reanimación.
Diplomado en Anestesiología Cardiovascular. Profesor Asistente. CIMEQ. e-mail: dearazoza@infomed.sld.cu
2.
Especialista de I y II Grados en Anestesiología y
Reanimación. Diplomado en Anestesiología Cardiovascular. Profesor e
Investigador Auxiliar. Instituto de Cardiología y Cirugía Cardiovascular. e-mail:
frs@infomed.sld.cu
3.
Especialista de I Grado en Anestesiología y Reanimación.
Diplomado en Anestesiología Cardiovascular. CIMEQ.
4.
Especialista de I Grado en Cirugía General y Cirugía
Cardiovascular. CIMEQ.
5.
Especialista de I Grado en Medicina General Integral.
Residente de tercer año de Cardiología. Hospital “Hermanos Ameijeiras”.
6.
Técnica de Anestesia Cardiovascular. CIMEQ.
Resumen
La cirugía cardíaca mínimamente invasiva tiene muchas
ventajas para el paciente; sin embargo, las dificultades para realizar e implementar
este procedimiento no se encuentran solamente
en la técnica quirúrgica, sino en el diseño de la técnica anestésica, que se convierte en un reto para el anestesiólogo. En
este artículo se presentan los primeros dos casos de sustitución valvular
mitral mínimamente invasiva realizados en el país. Se
describen las técnicas anestésicas, los resultados obtenidos, y se discuten las
ventajas y complicaciones de estas dos técnicas (anestésica y quirúrgica). Aunque esta serie es pequeña, creemos que constituye la
base para que esta técnica se desarrolle en nuestro centro, opción segura para
los pacientes con valvulopatía mitral no aceptados por cardiología
intervencionista.
Abstract
Minimally
invasive heart surgery has many advantages for the patient, however,
difficulties in performing and implementing this procedure are not only found
in surgical technique, but in the design of the anesthetic technique, which
becomes a challenge for the anesthesiologist. This article presents the first
two cases of minimally invasive mitral valve replacement performed in the
country. The anesthetic techniques and obtained results are described, and the
advantages and complications of these two techniques (anesthesia and surgery)
are discussed. Although this series is small, we believe that it is the basis
for developing this technique in our center, which is a safe option for patients
with mitral valve disease who are not accepted for interventional cardiology.
|
Palabras clave: CIRUGÍA TORACICA ASISTIDA POR VIDEO ANESTESIA DE CONDUCCION VALVULA MITRAL |
Key
words: THORACIC
SURGERY, VIDEO-ASSISTED ANESTHESIA, CONDUCTION MITRAL VALVE |
Introducción
La cirugía cardíaca mínimamente invasiva tiene muchas
ventajas para el paciente, que se deben fundamentalmente a que esta técnica
quirúrgica es menos cruenta que la cirugía cardíaca convencional1. Sin embargo, las
dificultades para realizar e implementar este
procedimiento no se encuentran solamente en la técnica quirúrgica, sino en el
diseño de la técnica anestésica1,2.
La conducción anestésica de estos pacientes se convierte en un reto para el
anestesiólogo, porque incluye los elementos de la fisiología de la postura, las
complicaciones de la posición, el uso de fármacos de muy corta duración o que
tengan antídoto, y la colocación de una sonda endotraqueal de doble luz, que
permita colapsar uno de los pulmones del paciente, y así facilitar la
visibilidad del cirujano al ampliar su campo quirúrgico.
A estas cuestiones debemos añadir que todas
estas técnicas anestésicas van a ser empleadas en pacientes que padecen de
valvulopatía mitral, con marcada predisposición a la aparición de arritmias perioperatorias,
frecuente asociación de lesión de otras válvulas cardíacas, isquemia
miocárdica, dilatación de cavidades cardíacas, posibles alteraciones de la fracción
de eyección del ventrículo izquierdo, así como la necesidad del uso de la
máquina de circulación extracorpórea y el pinzamiento aórtico que implican: anticoagulación,
y su posterior reversión, hemodilución, hipotermia, entre otros procedimientos.
Para esto se requiere una estrategia particular de ventilación, apoyo
inotrópico, vasoactivo o ambos, y una selección cuidadosa de los agentes
anestésicos para evitar la desaturación de O2 de la hemoglobina y el
deterioro hemodinámico1,2.
La sustitución valvular mitral es un procedimiento
ampliamente extendido en la actualidad, donde las complicaciones mayores
provienen de la agresividad de la cirugía y el abandono del tratamiento
anticoagulante. Con el objetivo de disminuir la esta agresividad de la
intervención quirúrgica, surgieron las intervenciones valvulares percutáneas en
1984, con la primera dilatación de la válvula mitral por esta vía3. Se han realizado
implantaciones de prótesis valvular aórtica
percutánea4, pero no
mitrales. La valvuloplastia mitral percutánea se realizó por primera vez en
Cuba en 19985, pero es
una solución temporal, útil en mujeres en edad fértil, gestantes o como puente
a la cirugía de sustitución valvular, además sólo puede aplicarse en las
estenosis, no en las insuficiencias3,5,6.
Tiene contraindicaciones frecuentes como clase funcional IV de
Casos Clínicos
Durante el período preoperatorio la
valoración clínica de los pacientes fue realizada por todo el equipo quirúrgico,
se analizaron sus estudios complementarios y se definió la estrategia
anestésica, quirúrgica y de la circulación extracorpórea. Se siguió el mismo
protocolo de la intervención quirúrgica convencional, incluida la medicación
preanestésica (apoyada en el uso de benzodiazepinas) la noche antes de la
intervención quirúrgica y a la llegada al quirófano.
Período
intraoperatorio
A los pacientes se les cateterizó una vena
del antebrazo izquierdo y la arteria radial del mismo lado en la unidad
quirúrgica. Para la inducción se administró midazolam (0,2 mg/kg), fentanil (10 mcg/kg)
y atracurio (0,6 mg/kg). Se colocó sonda
endotraqueal de doble luz Robertshaw izquierdo, la cual se cambió por una
convencional al finalizar la intervención quirúrgica. Se realizaron dos
abordajes venosos profundos, uno en la vena yugular
interna izquierda, para la ubicación de un introductor
Previo a la anticoagulación del paciente se colocó una sonda
de ecocardiografía transesofágica, con el objetivo de verificar la posición de
todas las cánulas y del Endoclamp® aórtico, así como para verificar la eliminación del aire
de las cavidades izquierdas al cierre de estas, y antes de retirar el Endoclamp®.
La dosis de heparina y su reversión se realizó según los criterios
de nuestro servicio para la cirugía de sustitución valvular mitral convencional:
heparina a 4 mg/kg para mantener el tiempo de coagulación activado (TCA)
superior a 500 segundos y sulfato de protamina, de 1,2-1,5 veces la dosis
administrada de heparina.
La estrategia ventilatoria utilizada durante el colapso
pulmonar derecho, para evitar la desaturación de O2 de la
hemoglobina, fue: a) mantener el mayor tiempo posible la ventilación a los dos pulmones;
b) mantener el volumen corriente a 10 ml/kg de peso y
Durante el período intraoperatorio se mantuvo una infusión continua de fentanil
(0,05 μg/kg/min) y se administraron dosis suplementarias de atracurio (0,05
mg/kg), midazolan (0,07mg/kg) e isoflurano inhalado, como complemento de la
anestesia general balanceada. Se procuró la comodidad del paciente en la
posición de decúbito lateral y durante los cambios de posición.
Todas las infusiones se colocaron en la misma línea
venosa profunda. Se profundizó la analgesia antes de las maniobras de máximo
dolor (apertura de la piel, costotomía, apertura del
pericardio, entre otras). Durante la circulación extracorpórea se disminuyó la
temperatura a
Se canuló la arteria femoral derecha para
colocar el Endoclamp® aórtico, que es
una sonda con globo que se introduce hasta la raíz de la aorta (unión
sinotubular) controlada por ecocardiografía transesofágica y una vez allí, se infló el globo,
para ocluir la aorta. A través de esta sonda se instiló la solución de
cardioplejía para detener el corazón. Se aspiró por una
sonda (vent) en aurícula izquierda a
través de la válvula protésica.
Se realizó la canulación fémoro-femoral izquierda más el drenaje
venoso de la yugular interna derecha para el empleo de la circulación
extracorpórea. Se colocó una prótesis valvular mitral por minitoracotomía
lateral derecha de
|
|
|
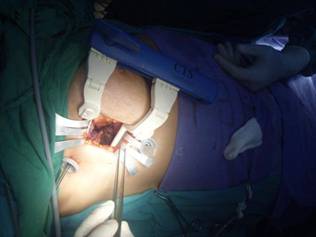
Fig 1.
Minitoracotomía lateral derecha de |
|
|
|
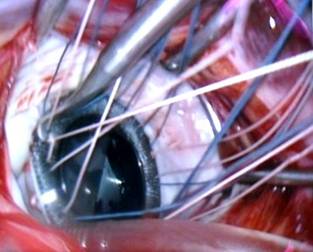
Fig 2. Colocación
de la prótesis con “baja hilos”. |
El seguimiento hemogasométrico y de la glucemia se
efectuó durante todo el período perioperatorio y cualquier alteración de alguno
de sus valores, fue corregida de inmediato. El nivel de heparinización fue
guiado por los TCA que se realizaron cada 1 hora, hasta su reversión.
Antes de finalizar la intervención quirúrgica se colocó un
drenaje y sello de agua, y se sustituyó el tubo de doble luz por un tubo
convencional.
El primer paciente tuvo un tiempo anestésico de 7,45
horas, 6 horas de tiempo quirúrgico, un tiempo de circulación extracorpórea de
159 minutos y 69 minutos de “pinzamiento” aórtico. Fue necesario transfundirlo
con dos unidades de glóbulos, y su hematócrito final, fue de 0,24 %.
El segundo, tuvo un tiempo anestésico de 5,20 horas,
quirúrgico de 4,40 horas, 137 minutos de circulación extracorpórea y 60 minutos
de “pinzamiento” aórtico. Se le realizó hemodilución normovolémica aguda y no
fue transfundido. El hematócrito final fue de 0,27 %.
Período postoperatorio
El primer caso se extubó a las 4,40 horas, la estadía en
El dolor postoperatorio se previno en ambos casos con la
administración intraoperatoria de tramadol 100 mg - diclofenaco 75 mg EV y por
el bloqueo intercostal (realizado por el cirujano) con alcohol absoluto. Se
continuó con analgésicos convencionales. La deambulación, en ambos casos, fue a
las 24 horas.
Comentario
La sustitución valvular mitral, mínimamente
invasiva, es un procedimiento seguro pero no está exento de complicaciones, se
han descrito lesiones del plexo braquial, desaturación de la hemoglobina,
atelectasias, acumulación de secreciones, barotrauma, arritmias, fibrilación
ventricular, hemorragia del sitio quirúrgico y de los puertos de acceso, y
perforación del parénquima pulmonar7.
No encontramos ninguna de ellas en nuestros pacientes durante los períodos
intra ni postoperatorio.
En cambio, este procedimiento tiene múltiples ventajas
para el paciente, entre ellas: menor “agresión”, dolor postoperatorio, tiempo
de intubación y ventilación postoperatoria, mínimo riesgo de infección y
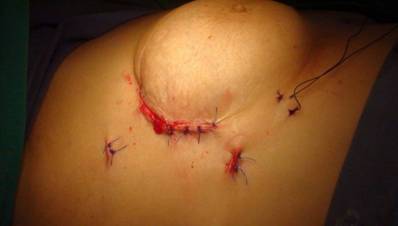
sangrado, reducida necesidad de transfusiones, y mejor cicatrización y estética
de la herida quirúrgica8-11 (Fig
3). Además, como la recuperación es más rápida y tiene menos complicaciones,
disminuye la estadía hospitalaria y el costo total de la intervención
quirúrgica8.
|
|
|
Fig 3 Cicatrices
quirúrgicas de 8 puntos y dos puertos de acceso. |
La conducción anestésica de las sustituciones valvulares
mínimamente invasivas, permite tres técnicas anestésicas: 1) anestesia general
convencional, 2) anestesia combinada (general-epidural) y 3) anestesia general
con tubo de doble luz y ventilación pulmonar independiente. Las dos primeras, necesitan
del uso de separadores pulmonares (que causan trauma pulmonar directo), por
parte del cirujano, y un gran dominio de la técnica quirúrgica. Nosotros
empleamos la anestesia general con tubo de doble luz y ventilación pulmonar
independiente hasta el fin de la circulación extracorpórea; una vez terminada
la intervención quirúrgica, se cambió el tubo de doble luz por un tubo
convencional. Creemos que la técnica anestésica que mayores beneficios trae al
paciente, es la anestesia combinada, ya que al administrarse un gran por ciento
de la anestesia a través del catéter epidural, se necesitan menores dosis de
relajantes musculares, opioides e hipnóticos, lo que permite una mejor
recuperación y control del dolor postoperatorio a través del catéter. Por el
temor a la aparición de hematoma peridural (1:120 000 casos), puede realizarse
la colocación del catéter epidural el día previo a la cirugía. Consideramos que
esta técnica debe utilizarse cuando el grupo quirúrgico tiene gran experiencia.
Conclusiones
Aunque esta serie es pequeña, apoyados en
ella y en los resultados de la bibliografía revisada, creemos que es de vital
importancia la discusión colectiva y la planificación individualizada de cada
paciente.
La conducción anestésica de este
procedimiento es segura y factible en nuestro medio, de fácil recuperación y presenta
pocas complicaciones postoperatorias. Es una buena opción para los pacientes con
valvulopatía mitral que no cumplen los criterios para la técnica percutánea, y
con estas mismas técnicas pudieran realizarse valvuloplastias mitrales.
Nota
del Editor
* Invasiva, este término
viene del inglés invasive, cuya traducción directa es
“invasivo/a”. Siempre que se refiera a una técnica o procedimiento diagnóstico
o terapéutico, es un anglicismo.
Referencias bibliográficas
1. Vistarini N, Aiello M,
Mattiucci G, Alloni A, Cattadori B, Tinelli C, et al: Port-access minimally invasive surgery for atrial septal
defects: A 10-year single center experience in 166 patients. J Thorac
Cardiovasc Surg. 2010,139(1):139-45.
2. Iribarne A, Russo MJ,
Moskowitz AJ, Ascheim DD, Brown LD, Gelijns AC. Assessing technological change
in cardiothoracic surgery. Semin Thorac Cardiovasc Surg. 2009;21(1):28-34.
3. Inoue K, Owaki T,
Nakamura t, Kitamura F, Miyamoto N. Clinical application of intravenous mitral
commissurotomy by a new ballon catheter. J Thorac Cardiovasc Surg.
1984;87(3):394-402.
4. Andersen HR, Knudsen LL,
Hasenkam JM. Transluminal implantation of aortic heart valves. Description of a
new expandable aortic valve and initial results with implantation by catheter
technique in closed chest pigs. Eur Heart J. 1992;13(5):704-8.
5.
Echarte-Martínez JC, Valiente-Mustelier J, García
Fernández R, Duque Pérez Y. Resultados de la valvuloplastia mitral percutánea.
Experiencia en el Instituto de Cardiología y Cirugía Cardiovascular de Cuba
(1998-2004). CorSalud [Internet]. 2010 citado 8 Mayo 2011];2(1):[aprox. 3 p.].
Disponible en: http://corsalud.vcl.sld.cu/sumario/2010/v2n1a10/resultadoscopia.htm
6.
Vahanian A, Baumgartner H, Bax J, Butchart E, Dion R,
Filippatos G, et al. Guía de Práctica
Clínica sobre el tratamiento de las valvulopatías. Rev Esp Cardiol. 2007;
60:625.e1-625.e50.
7. Tsai FC, Lin PJ, Chang
CH, Liu HP, Tan PP, Lin FC, et al.
Video-assisted cardiac surgery. Preliminary experience in reoperative mitral
valve surgery. Chest. 1996;110(6):1603-7.
8. Felger JE, Chitwood WR,
Nifong LW, Holbert D. Evolution of mitral valve surgery: toward a totally
endoscopic approach. Ann Thorac Surg. 2001;72(4):1203-8.
9. Marseu
K, Slinger P, de Perrot M, et al. Dynamic hyperinflation and cardiac arrest during one
lung ventilation: a case report. Can J Anaesth. 2011;58(4):396-400.
10. Olper L, Cabrini L,
Landoni G, Rossodivita A, Nobile L, Monti G, et al. Non-invasive ventilation after cardiac surgery outside the
Intensive Care Unit. Minerva Anestesiol. 2011;77(1):40-5.
11. Leontyev S, Borger MA,
Modi P, Lenhmann S, Seeburger J, Walther T, et
al. Redo aortic valve surgery: Influence of prosthetic valve endocarditis
on outcomes. J Thorac Cardiovasc Surg. 2011;142(1):99-105.
Recibido: 16 de julio de 2011
Aceptado para su publicación: 12 de agosto de 2011