CorSalud 2011;3(2)
INSTITUTO DE
CARDIOLOGÍA Y CIRUGÍA CARDIOVASCULAR
CIUDAD DE
CASO CLÍNICO
CONDUCTO ARTERIOSO PERSISTENTE
EN EL ADULTO.
A PROPÓSITO DE UN CASO
Por:
Dr. Alexander Valdés Martín1 y Dra. Sherien Sixto Fernández2
______________
1.
Especialista
de I Grado en Medicina General Integral y Cardiología. e-mail: avaldes@infomed.sld.cu
2.
Especialista
de I Grado en Cardiología. Asistente. Investigadora Agregada.
Resumen
El conducto arterioso durante el período fetal permite la comunicación
entre la aorta descendente y el tronco pulmonar principal lo que favorece la
existencia de un circuito preferencial entre la sangre de la placenta y la
circulación sistémica, a la vez que evita el circuito pulmonar. En la vida
posnatal se produce un cierre, inicialmente, funcional y luego, anatómico del
conducto, por lo que el fracaso de este proceso condicionará la persistencia de
esta estructura en la vida fetal. El cierre quirúrgico del conducto arterioso
en adultos implica riesgos debido a sus cambios anatómicos e histológicos. En
la actualidad la oclusión percutánea como primera línea de tratamiento, es la
opción más recomendada, de ahí que sea el dispositivo Amplatzer Duct Occluder II (ADO II) uno de los más utilizados. En
este artículo presentamos el caso de un paciente adulto con esta enfermedad y
se muestran las imágenes ecocardiográficas, tomográficas y angiográficas.
Abstract
The ductus arteriosus during the fetal period allows
communication between the descending aorta and the main pulmonary trunk, which
favors the existence of a preferential circuit between placental blood and
systemic circulation, while avoiding the pulmonary circuit. In postnatal life a
duct closure takes place, functional at first and then anatomical, so the
failure of this process will determine the persistence of this structure in
fetal life. Surgical closure of ductus arteriosus in adults involves risks due
to its anatomical and histological changes. Currently, percutaneous occlusion
as first line treatment is the most recommended choice, that is why the
Amplatzer Duct Occluder II (ADO II), is one of the most used. In this paper, we
present the case of an adult patient who suffers from this disease; also
echocardiographic, tomographic and angiographic images are shown.
|
Palabras clave: CONDUCTO ARTERIOSO PERSISTENTE TRATAMIENTO AVANZADO AMPLATZER |
Key
words: DUCTUS
ARTERIOSUS, PATENT ADVANCED
TREATMENT AMPLATZER |
Introducción
El conducto arterioso es un componente normal y esencial durante el
desarrollo embriológico del sistema cardiovascular. En fetos normales el ductus, como también suele llamársele,
se origina distalmente al arco aórtico izquierdo. Durante el período fetal
permanece la comunicación entre la aorta descendente (cerca del origen de la
arteria subclavia izquierda) y el tronco pulmonar principal (cerca de su
bifurcación). Las variaciones de localización, bien a nivel del arco o ramas
vasculares en los que se origina, pueden dar como resultado una posición
anormal o bien un conducto arterioso persistente (CAP) bilateral1. La presencia del conducto
arterioso en el período fetal es fundamental para permitir el cortocircuito
preferencial entre la sangre rica en oxígeno y nutrientes de la placenta hacia
la circulación sistémica fetal, lo que evita el circuito pulmonar. En el
momento del nacimiento se produce el cierre espontáneo del ductus entre las 15-18 horas de vida. El incremento de la tensión
arterial de oxígeno con el inicio de la respiración espontánea que sucede al
nacer, sumado al descenso en los niveles de prostaglandinas circulantes
secundarias al metabolismo pulmonar activo y la retirada de la placenta, son
factores que condicionan el cierre funcional del conducto arterioso, seguido de
la fibrosis y el cierre anatómico entre los 15 y 21 días de vida. El fracaso de
este proceso a los 3 meses condicionará la persistencia de la permeabilidad de
dicha estructura fetal2.
La incidencia del CAP se calcula en torno a 1 cada 2.000-5.000 nacidos vivos, y
no es frecuente en la población adulta. La historia natural dependerá del
tamaño del ductus y el cortocircuito
de izquierda a derecha resultante3.
En el niño, la presencia de un CAP puede ser beneficiosa en una amplia variedad
de malformaciones cardiovasculares, como es el caso de la estenosis severa o la
atresia pulmonar. En estas afecciones, llamadas ductus dependientes, el cierre del CAP esta formalmente
contraindicado, pues a través de él se garantiza la llegada de sangre a los
pulmones. En el adulto, el CAP no suele asociarse a otras anomalías congénitas
y se presenta básicamente de las siguientes formas: como un CAP pequeño sin
repercusión hemodinámica; como un CAP de moderada repercusión, que condiciona
algún grado de insuficiencia cardíaca izquierda y finalmente; como un CAP
grande, que condiciona la enfermedad obstructiva vascular pulmonar severa4.
Caso clínico
Paciente masculino, color de la piel negra, 39 años de edad y antecedentes
de aparente salud hasta noviembre del 2010, que comienza con astenia y disnea a
los esfuerzos moderados e intensos. Al examen físico se constató un soplo
continuo áspero con epicentro en primer y segundo espacio intercostal por
debajo de la región clavicular izquierda. Los pulsos arteriales periféricos
eran saltones, y se palpaba un impulso ventricular izquierdo mantenido e
hiperdinámico. El electrocardiograma mostró un ritmo sinusal con un eje
eléctrico del QRS localizado en el cuadrante inferior izquierdo y la presencia
de ondas R altas en aVL y aVF. En el estudio radiológico del tórax se observó
un incremento del flujo pulmonar periférico con dilatación leve del tronco de
la arteria pulmonar y sus ramas principales, cardiomegalia producida por el
crecimiento de las cavidades izquierdas y un botón aórtico prominente. El estudio
ecocardiográfico evidenció la siguiente descripción: situs solitus visceral, concordancia ventrículo-arterial y aurículo-ventricular,
y el diámetro telediastólico del ventrículo izquierdo, levemente aumentado (
|
|
|
|
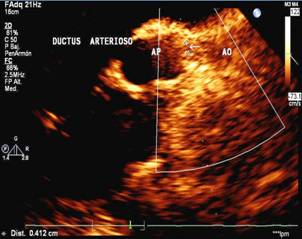
Fig 1. Ecococardiografía
bidimensional (2D). Vista supraesternal. La flecha
señala la presencia de un ductus arterioso persistente. |
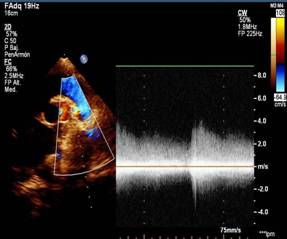
Fig 2. Ecocardiografía supraesternal. Se observa mapeo de color patológico con
espectro de Doppler continuo al inicio de la rama
pulmonar izquierda. |
|
|
|
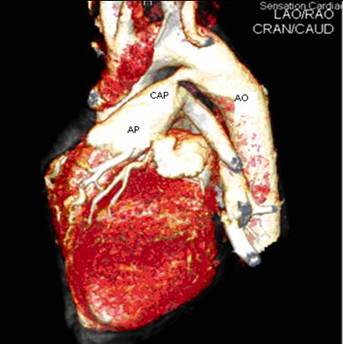
Fig 3. Tomografía computarizada helicoidal con reconstrucción
tridimensional (3D), donde se visualiza CAP tipo A de la clasificación de Krichenko, que mide 3- |
Se procedió al cierre del CAP bajo
sedación. Se canalizaron arteria y vena femorales, y se administró 30 mg/kg de
cefazolina al inicio del cateterismo y 100 U/kg de peso de heparina sódica tras
canalizar la arteria. Después de registrar las presiones pulmonares y
sistémicas, se realizó un aortograma en proyección lateral para corroborar la
morfología y tamaño del ductus. Este
se canalizó por vía anterógrada, y se sustituyó el catéter multipropósito por
la vaina, con guía de intercambio de 0,35''; luego se seleccionó un dispositivo
Amplatzer Duct
Occluder II (ADO II) de
|
|
|
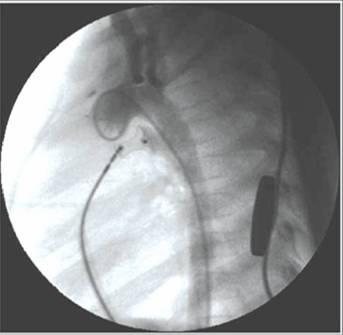
Fig 4. Angiografía lateral con el dispositivo ADO
II implantado, aún anclado al cable liberador. |
Durante las 24 horas siguientes al
cateterismo se administraron tres dosis adicionales de cefazolina, y se siguió el
esquema inicial con intervalos de 8 horas entre cada administración. Al
siguiente día el paciente fue egresado, después de demostrar la ausencia de
cortocircuito residual por eco-Doppler.
Discusión
El tratamiento quirúrgico del CAP en adultos se efectúa
mediante toracotomía lateral izquierda, aunque podría requerir esternotomía
media y otros procedimientos como la utilización de circulación extracorpórea y
pinzamiento aórtico. Todo lo antes señalado junto a los cambios anatómicos e
histológicos producidos en el CAP, como la calcificación, el desarrollo de aneurisma,
divertículo, acortamiento y friabilidad, incrementan los riesgos de
complicaciones durante y tras la cirugía5,6. En la actualidad la oclusión percutánea, como
primera línea de tratamiento, es la opción más recomendada por la mayor parte
de los cardiólogos, y tiene mayor connotación en el paciente adulto con CAP
sintomático. De no tratarlo, el CAP puede favorecer el desarrollo de
endarteritis infecciosa y el temido síndrome de Eisenmenger7, por citar solo dos ejemplos. El cierre percutáneo del ductus es una técnica bien establecida, con baja incidencia de complicaciones
sistémicas; sin embargo, y a pesar de los diferentes dispositivos hasta ahora
empleados, como el doble paraguas de Rashkind
o las endoprótesis espirales de liberación controlada, el cierre de los CAP
moderados o grandes puede acompañarse de complicaciones como: cortocircuitos residuales,
embolizaciones del dispositivo y necesidad de implantar, en ocasiones, más de
un dispositivo8.
El dispositivo ADO II aporta varias mejoras
sobre los utilizados hasta ahora: el cierre del ductus se produce por la barrera mecánica que produce la prótesis,
además de por el efecto trombogénico de los parches de poliéster de su
interior, lo que disminuye la incidencia de cortocircuito residual. Además,
este dispositivo puede reposicionarse y extraerse mientras permanece anclado al
cable liberador, por lo que de este modo disminuye el riesgo de embolización. El cierre del
CAP con un ADO II en nuestro paciente fue exitoso, con una oclusión total del
defecto a las 24 horas. Este resultado coincide con lo
informado por otros autores9,
lo que confirma la elevada eficacia del Amplatzer
en el cierre del ductus moderado.
Referencias
bibliográficas
1.
Conelly MS, Webb GD,
Sommerville J, Warnes CA, Perloff JK, Liberthson RR, et al. Canadian Consensus Conference on congenital Heart defects in
the Adults 1996. Can J Cardiol. 1998;14(4):533-97.
2. Bermúdez-Cañete R, Abelleira C, Sánchez I. Cardiopatías
congénitas del adulto: Procedimientos terapéuticos percutáneos. Rev Esp
Cardiol. 2009(Supl. E):75-97.
3.
Warnes CA, Williams RG, Bashore TM,
Child JS, Connolly HM, Dearani JA, et al.
ACC/AHA 2008 Guidelines for the Management of Adults With Congenital Heart
Disease. J Am Coll Cardiol. 2008;52(23):e1-121.
4. Hannoush
H, Tamim H, Younes H, Arnaout S, Gharzeddine W, Dakik H et al. Patterns of congenital
heart disease in unoperated adults: a 20-year experience in a developing
country. Clin Cardiol. 2004;27(4):236-40.
5.
Toda R, Moriyama Y, Yamashita M,
Iguro Y, Matsumoto H, Yotsumoto G. Operation for adult patent ductus arteriosus
using cardiopulmonary bypass. Ann Thorac Surg. 2000;70(6):1935-8.
6.
Omari BO, Shapiro S, Ginzton L,
Milliken JC, Baumgartner FJ. Closure of short, wide patent ductus arteriosus
with cardiopulmonary bypass and balloon occlusion. Ann Thorac Surg.
1998;66(1):277-8.
7.
García-Montes JA, Zabal-Cerdeira C,
Calderón-Colmenero J, Juanico-Enríquez A, Cardona-Garza A, Colín-Ortiz JL, et al. Patent ductus arteriosus in the
adult: transcatheher treatment immediate and medium term results. Arch Cardiol
Mex. 2006;76(2):163-8.
8. Novo
García E, Bermúdez R, Herraiz I, Salgado A, Balaguer J, Moya JL, et al. Cierre de ductus en adultos
mediante dispositivo de Rashkind: resultados comparativos. Rev Esp Cardiol.
1999;52(3):172-80.
9.
Thanapoulos D, Hakim FA, Hiari A,
Goussos Y, Basta E, Zarayelyan AA, et al. Further experience with transcatheter
closure of the patent ductus arteriosus using the amplatzer duct occluder. J Am
Coll Cardiol. 2000;35(4):1016-21.
Recibido: 16 de mayo del
2011
Aceptado para
su publicación: 31 de mayo del 2011