CorSalud
2011;3(2)
CENTRO
DE INVESTIGACIONES MÉDICO QUIRÚRGICAS
CASOS CLÍNICOS
CONDUCCIÓN
ANESTÉSICA DE
Por:
MSc.Dr.
Antonio de Arazoza Hernández1, Dr. Fausto Leonel Rodríguez Salgueiro2,
Dr. Miguel Ángel Carrasco Molina3, MSc.Dr. Osvaldo Valdés Dupeirón4
y Dra. Elizabeth Rodríguez Rosales5
______________
1.
Máster en Urgencias y Emergencias Médicas. Especialista
de I Grado en Medicina General Integral y en Anestesiología y Reanimación. Diplomado
en Anestesiología Cardiovascular.
c-electrónico: dearazoza@infomed.sld.cu
2.
Especialista de I y II Grados en Anestesiología y
Reanimación. Diplomado en Anestesiología Cardiovascular. Profesor e
Investigador Auxiliar. c-electrónico: frs@infomed.sld.cu
3.
Especialista de I Grado en Cirugía General y Cirugía
Cardiovascular.
4.
Máster en Urgencias y Emergencias Médicas. Especialista
de I Grado en Cirugía Cardiovascular.
5.
Especialista de I Grado en Medicina General Integral. Residente
de tercer año de Cardiología.
Resumen
Las ventajas de la cirugía cardíaca video-asistida son
muy necesarias para los pacientes de alto riesgo; pero someterlos a sus
posibles complicaciones es una gran responsabilidad y un reto para el
anestesiólogo cardiovascular. En este artículo se presentan los primeros cinco
casos de revascularización miocárdica video-asistida del país, se describen las
técnicas anestésicas y los resultados obtenidos; además, se discuten las
ventajas de esta técnica quirúrgica: menor agresión, dolor postoperatorio,
tiempo de intubación y ventilación postoperatoria, mínimo riesgo de infección y
sangrado, reducida necesidad de transfusiones, y mejor cicatrización y estética
de la herida. Se concluye que aunque esta serie es pequeña, consideramos que es
una buena opción para los pacientes con cardiopatía isquémica y criterio de revascularización
de un solo vaso (arteria descendente anterior) no accesible por
intervencionismo.
Abstract
The advantages of video-assisted cardiac surgery are very
necessary for high-risk patients, but subjecting them to possible complications
is a big responsibility and a challenge for the cardiovascular
anesthesiologist. This article presents the first five cases of video-assisted
coronary artery bypass grafting in the country, and describes the anesthetic
techniques and results. Also, the advantages of this surgical technique are
discussed: less invasive, less postoperative pain, less duration of
postoperative intubation and ventilation, minimal risk of infection and
bleeding, reduced need for transfusions, and better healing and aesthetics of
the wound. It was concluded that although this series is small, we consider it a
good option for patients with ischemic heart disease and a single-vessel
(anterior descending artery) revascularization criterion, not accessible to
intervention.
|
Palabras clave: CIRUGIA CARDIACA VIDEO-ASISTIDA REVASCULARIZACION MIOCARDICA ANESTESIA DE CONDUCCION |
Key words: VIDEO-ASSISTED CARDIAC SURGERY MYOCARDIAL REVASCULARIZATION ANESTHESIA, CONDUCTION |
Introducción
La cirugía
video-asistida (comúnmente llamada laparoscópica,
cuando se desarrolla en la cavidad abdominal) brinda mayor comodidad y “agrede" menos al paciente que la cirugía convencional1. Es un reto la conducción
anestésica, por incluir elementos propios como los relacionados con la
fisiología de la postura, las complicaciones de la posición, la inducción de un
pneumoperitoneo con CO2, y el uso de
drogas de muy corta duración o que tengan antídoto. La cirugía video-asistida
torácica, necesita la colocación de una sonda endotraqueal
de doble luz que permita colapsar uno de los pulmones del paciente, para
facilitar la visibilidad del cirujano al ampliar su campo quirúrgico1,2.
La aplicación de esta técnica quirúrgica en cirugía cardiovascular aumenta el
riesgo anestésico-quirúrgico por la presencia de una cardiopatía subyacente,
predisposición a la aparición de arritmias perioperatorias
y la frecuente asociación con isquemia miocárdica, dilatación de cavidades
cardíacas, fracción de eyección del ventrículo izquierdo reducida o algún grado
de insuficiencia o estenosis valvular.
Se requiere de una estrategia particular de ventilación,
apoyo inotrópico, vasoactivo
o ambos y una selección cuidadosa de los agentes anestésicos, para evitar la desaturación de O2 de la hemoglobina y el
deterioro hemodinámico1,3,4.
La revascularización miocárdica
es uno de los pilares del tratamiento de las enfermedades coronarias en los
últimos cincuenta años. La cirugía de revascularización
coronaria es un procedimiento ampliamente extendido en la actualidad3. Con el objetivo de
disminuir la agresividad de la intervención quirúrgica, surgieron las
intervenciones coronarias percutáneas, utilizadas en
los últimos treinta años3,
con limitaciones obvias, que van desde la vía de acceso difícil hasta la reestenosis de las endoprótesis
liberadoras de fármacos. Desde 1992 se desarrollan otras técnicas con el
objetivo de disminuir los efectos deletéreos de la intervención quirúrgica
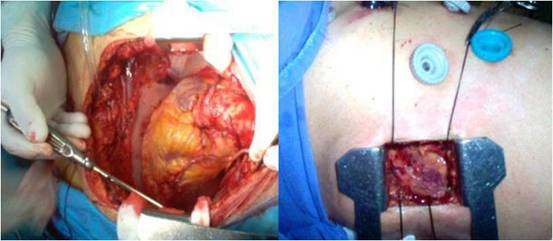
convencional, como la cirugía cardíaca mínimamente agresiva (Fig 1), Port Access Cardiac Surgery, Cirugía Robótica y hasta de Tele robótica1-5. En nuestro país se ha
realizado la revascularización miocárdica
video-asistida a cinco pacientes y son los que presentamos a continuación.
|
|
|
Fig 1. Injerto de
arteria mamaria interna de forma convencional (izquierda) y
video-asistida (derecha). |
Casos Clínicos
Se realizó la valoración clínica preoperatoria de los
pacientes, así como sus estudios complementarios; se les administró la
medicación preanestésica (apoyada en el uso de benzodiazepinas) con el mismo
protocolo de la intervención quirúrgica convencional, y se hizo énfasis en la
exploración cardiorrespiratoria.
Período
intraoperatorio
A todos los pacientes se les cateterizó una vena del
antebrazo izquierdo y la arteria radial izquierda a su llegada al quirófano. Para
la inducción se administró midazolam (0,2 mg/kg), fentanil (10 mcg/kg) y atracurio
(0,6 mg/kg). Se colocó una sonda endotraqueal de doble luz Robertshaw derecho,
la cual se cambió por una convencional al finalizar la intervención quirúrgica.
Se realizaron dos abordajes venosos profundos en el hemitórax izquierdo. La monitorización
utilizada, fue la establecida para la cirugía cardíaca convencional. Para la profilaxis
antibiótica se administró cefazolina [1 gramo endovenoso (EV) cada 12 horas]; y
para la fibrinólisis, ácido tranexámico (10 mg/Kg) EV previo al estímulo
quirúrgico, el cual se repitió en igual dosis después de finalizar la
circulación extracorpórea (antes de administrar sulfato de protamina). La dosis
de heparina y su reversión, siguió los mismos criterios de nuestro servicio
para la cirugía de revascularización miocárdica con corazón latiendo (heparina
a 2 mg/kg para mantener el tiempo de coagulación activado (TCA) superior a 200
segundos y sulfato de protamina (de 1,2-1,5 veces la dosis administrada de heparina).
La estrategia ventilatoria utilizada durante el colapso pulmonar,
para evitar la desaturación de O2 de la hemoglobina fue: a) mantener
el mayor tiempo posible la ventilación a los dos pulmones, b) mantener el volumen
corriente a 10 ml/kg de peso y
Durante el período intraoperatorio se mantuvo infusión continua
de fentanil (0,05 μg/kg/min) y se administraron
dosis suplementarias de atracurio (0,05 mg/kg), midazolan (0,07 mg/kg) e isoflurano
inhalado, como complemento de la anestesia general balanceada. Se administró
también, nitroglicerina en infusión continua a muy baja dosis. Se procuró la
comodidad del paciente en la posición de decúbito lateral y durante los cambios
de posición. Todas las infusiones se colocaron en la misma línea venosa
profunda. Se profundizó la analgesia previa a las maniobras de máximo dolor
(apertura de la piel, costotomía, apertura del pericardio, entre otras). Se
mantuvo al paciente en normotermia con el uso de manta térmica y calentamiento
de las soluciones a administrar. No se necesitó apoyo inotrópico en ningún
paciente por la buena estabilidad hemodinámica que presentaron.
Se realizó el seguimiento hemogasométrico y de la
glucemia durante todo el período perioperatorio, y cualquier alteración de
alguno de sus valores, fue corregida de inmediato. El nivel de heparinización
fue controlado mediante los TCA que se realizaron cada una hora, hasta su
reversión.
Todos los pacientes fueron revascularizados con puente de
arteria mamaria izquierda nativa a la arteria descendente anterior; no se
realizó canulación fémoro-femoral previa para circulación extracorpórea de
apoyo (de ser necesario), aunque sí se colocó introductor
|
|
Período postoperatorio
Los pacientes se extubaron a las 3,25 horas como
promedio, tiempo menor que con la cirugía cardiovascular convencional. El dolor
postoperatorio se previno con la administración intraoperatoria de tramadol 100
mg - diclofenaco 75 mg EV y por el bloqueo intercostal (realizado por el
cirujano) con alcohol absoluto. Se continuó la analgesia con analgésicos
convencionales. La deambulación fue rápida. La estadía en
Comentario
La revascularización miocárdica
video-asistida no está exenta de complicaciones, se han descrito lesiones del
plexo braquial, desaturación de la hemoglobina, atelectasias, acumulación de secreciones, barotrauma, arritmias, fibrilación ventricular, hemorragia
del sitio quirúrgico y de los puertos de acceso, y perforación del parénquima
pulmonar6. Como la
cavidad torácica no es tan distensible, no se utiliza CO2 para
ampliar el campo quirúrgico, y no se describen las complicaciones que le pueden
ser atribuibles (náuseas, vómitos, hipotensión arterial, hipertensión arterial,
dolor abdominal, cervical y cérvico-braquial,
embolismo gaseoso, neumotórax, neumomediastino, hipercapnia, sudoración, entre otros), muy comunes en
intervenciones quirúrgicas video-asistidas de la cavidad abdominal6,7.
Todas las complicaciones son prevenibles y tratables, no encontramos ninguna de
ellas en nuestra serie.
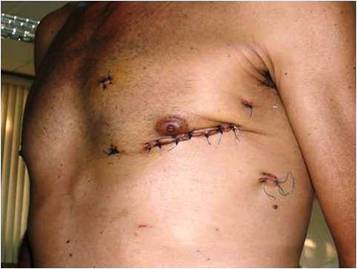
En cambio, este procedimiento tiene múltiples ventajas
para el paciente. Entre ellas, menor agresión, dolor postoperatorio, tiempo de
intubación y ventilación postoperatoria, mínimo riesgo de infección y sangrado,
reducida necesidad de transfusiones, y mejor cicatrización y estética de la
herida quirúrgica (Fig 2). Además, como la
recuperación es más rápida y existen menos complicaciones, disminuye la estadía
hospitalaria y el costo total de la intervención quirúrgica1,2,4.
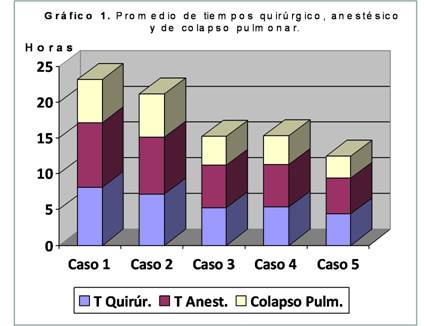
Consideramos
que los tiempos quirúrgico, anestésico y de colapso pulmonar total fueron altos
(fundamentalmente por la disección de la arteria mamaria interna); pero con más
entrenamiento y mayor número de intervenciones
quirúrgicas, éstos pueden disminuirse significativamente y valorar en un
futuro, la posibilidad de extubar al paciente en el
quirófano, y disminuir las posibles complicaciones derivadas de la ventilación
postoperatoria8-10.
|
|
|
Fig 2. Cicatrices
quirúrgicas a los 3 días de la cirugía. |
Conclusiones
Aunque esta serie es pequeña, apoyados en ella y en los
resultados de la literatura revisada, creemos que la conducción anestésica de
la revascularización miocárdica video-asistida es una técnica segura, por ser esta
intervención quirúrgica poco agresiva, de fácil recuperación y que presenta
pocas complicaciones postoperatorias. Es una buena opción para los pacientes
con cardiopatía isquémica y criterio de revascularización de un solo vaso (arteria
descendente anterior), no accesible por intervencionismo.
Referencias bibliográficas
1.
2.
Iribarne A,
Russo MJ, Moskowitz AJ, Ascheim
DD, Brown LD, Gelijns AC. Assessing technological change
in cardiothoracic surgery. Semin Thorac Cardiovasc Surg. 2009;21(1):28-34.
3.
Wijns W, Kolh P, Danchin N,
Di Mario C, Falk V, Folligue
T, et al. Guía de práctica clínica
sobre revascularización miocárdica-2da. edición
corregida el 10 de mayo de 2011. Rev Esp Cardiol. 2010;63(12):1485.e1-e76.
4.
Vistarini N, Aiello M, Mattiucci G, Alloni A, Cattadori B, Tinelli C, et al: Port-access minimally invasive
surgery for atrial septal
defects: A 10-year single center experience in 166
patients. J Thorac Cardiovasc
Surg 2010,139(1):139-45.
5.
Prasad SM, Ducko CT, Stephenson ER, Chambers CE, Damiano
RJ. Prospective clinical trial of robotically assisted endoscopic
coronary grafting with 1-year follow-up. Ann Surg. 233(6):725-32.
6.
Min SY, Park DW,
7.
Parsonnet V, Dean D,
Bernstein AD. A method of uniform stratification of risk for evaluating
the results of surgery in acquired adult heart disease. Circulation. 1989;79(
8.
Schomig A, Mehilli J, de Waha A, Seyfarth M, Pache J, Kastrati A. A meta-analysis of 17 randomized trials of a percutaneous coronary intervention-based strategy in
patients with stable coronary artery disease. J Am Coll
Cardiol. 2008;52(11):894-904.
9. Taggart
DP. Thomas B. Ferguson Lecture. Coronary artery bypass grafting is still the
best treatment for multivessel and left main disease,
but patients need to know. Ann Thorac Surg. 2006;82(6):1966-75.
10. Naik H, White AJ, Chakravarty
T, Forrester J,
Recibido: 19 de mayo de 2011
Aceptado para
su publicación: 27 de mayo de 2011