CorSalud
2010;2(4)
CARDIOCENTRO
"ERNESTO CHE GUEVARA"
SANTA CLARA, VILLA CLARA, CUBA
ARTÍCULO DE REVISIÓN
MECANISMOS ELECTROFISIOLÓGICOS DE
HIPÓTESIS ACTUAL
Por:
Lic. Raimundo Carmona Puerta1, Dr. Ginner O. Rizo
Rivera2, Dr. Elibet Chávez González3
______________
1.
Especialista
de I Grado en Fisiología Normal y Patológica.
Servicio de Electrofisiología Cardíaca Clínica y Estimulación. Cardiocentro "Ernesto
Che Guevara", Santa Clara, Villa Clara. Asistente. UCM-VC. email: raimundo@cardiovc.sld.cu
2.
Especialista
de I Grado en Cardiología. Servicio de
Cardiología del Hospital Universitario “Arnaldo Milián Castro”. Santa Clara,
Villa Clara.
3.
Especialista
de I Grado en Cardiología. Servicio de
Electrofisiología Cardíaca Clínica y Estimulación. Cardiocentro "Ernesto
Che Guevara", Santa Clara, Villa Clara. Instructor. UCM-VC.
Resumen
El origen de la elevación del segmento ST elevado durante el
infarto agudo de miocardio (IMA) ha sido motivo de controversia. Con el avance
de la electrofisiología cardíaca básica, hoy puede suponerse con alto grado de
fiabilidad, las bases iónicas que generan la modificación del
electrocardiograma clínico. A partir de una heterogeneidad eléctrica que existe
en condiciones normales la isquemia miocárdica aguda, induce a una exacerbación
de este comportamiento fisiológico y crea gradientes eléctricos transmurales significativos,
que producen vectores potentes de corriente desde el endocardio al epicardio.
Una respuesta diferente desde el punto de vista electrofisiológico, ante tal
estímulo anormal, crea el sustrato funcional para tal discrepancia eléctrica a
través del espesor de las paredes cardíacas.
Abstract
The origin
of the ST segment elevation during acute myocardial infarction (AMI) has been
the object of controversy. The advances in basic cardiac electrophysiology has
made possible to assume, with a high degree of reliability, the ionic bases
that generate the clinical electrocardiogram change. Starting from an
electrical heterogeneity that exists in normal conditions, the acute myocardic
ischemia induces an exacerbation of this
physiological behavior and creates significant transmural electric gradients,
which produces powerful electrical current vectors from the endocardium to the
epicardium. A different response from the electrophysiological point of view,
in the presence of such abnormal stimuli, creates a functional substratum for
such an electric discrepancy through the thickness of the cardiac walls.
|
Palabras
clave: ELECTROCARDIOGRAFIA INFARTO DEL MIOCARDIO ELECTROFISIOLOGIA FISIOPATOLOGIA |
Key words: ELECTROCARDIOGRAPHY MYOCARDIAL
INFARCTION ELECTROPHYSIOLOGY PHYSIOPATHOLOGY |
Cuando se estudia el infarto agudo de miocardio (IAM) con
elevación del ST, la literatura, a menudo no trata las causas electrofisiológicas
básicas responsables de la elevación del punto J y el segmento ST, otras veces
el lector se ve abrumado con una cantidad de elementos que nunca le permiten la
total comprensión del tema. En otras ocasiones se ha observado la presentación
de este tema de forma no integrada, por tanto decidimos redactar este artículo
para explicar, de la manera más sencilla posible, tan interesante y complejo tema.
Hacia 1985 solo se aceptaba que los ventrículos del corazón
estaban constituidos por dos tipos principales de células: las del sistema
especializado de conducción His-Purkinje
y cardiomiocitos de trabajo. Se creía que el
miocardio ventricular era totalmente homogéneo con respecto a sus propiedades eléctricas,
a su respuesta ante los fármacos, hormonas y otros moduladores de la actividad
cardíaca. Estudios llevados a cabo en el Masonic Research Laboratory
de New York, con el profesor Antzelevitch al frente
de ellos, revelaron que esto estaba lejos de ser cierto1. Hoy se acepta que el miocardio ventricular se compone
al menos de tres tipos de células distintas, desde el punto de vista electrofisiológico
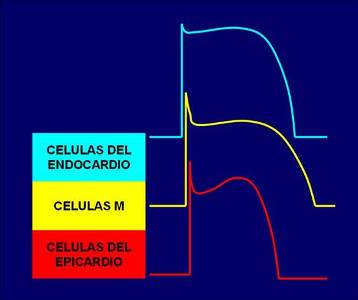
y funcional, estas son: epicárdicas, M y endocárdicas1,2 (Fig 1).
Sus diferencias radican principalmente a nivel de las fases
1 y 3 del potencial de acción (PA) cardíaco1.
|
|
|
Fig 1
Representación gráfica de los potenciales de acción encontrados en células
del miocardio transmural. Obsérvese que existen tres tipos celulares con
comportamiento electrofisiológico distinto. |
Heterogeneidad en la
fase 1
La fase 1 del PA tiene el aspecto morfológico de una espiga
y es conocido también, como fase de repolarización temprana. Se produce
primariamente por una corriente de salida de potasio con cinética de activación
e inactivación rápida, referida como ITO13,4. Esta corriente predomina
en las células del epicardio y en las M, pero se manifiesta con menor densidad
en los miocitos endocárdicos1.
Esto trae como consecuencia que ambos tipos de células presenten una espiga significativa
en la fase 1, lo cual apenas ocurre en las células del endocardio. Existen además,
diferencias interventriculares de ITO1, esta tiene una mayor
densidad en el epicardio del ventrículo derecho respecto al epicardio del
ventrículo izquierdo, lo cual sienta las bases para la ocurrencia del síndrome
de Brugada5.
Heterogeneidad en la
fase 3
Se puede considerar que el miocardio transmural es
histológicamente similar. No obstante, en la región del miocardio medio existen
poblaciones de un grupo particular de células que muestran un comportamiento
distintivo desde el punto de vista funcional1. Estas células, conocidas como células M, exhiben una
prolongación desproporcionada en la duración de su potencial de acción (DPA)
respecto a otras células del miocardio ventricular, cuando la frecuencia de estimulación
es lenta o en respuesta a agentes prolongadores del PA6-9. Las bases iónicas de este comportamiento, incluyen
un nivel reducido de expresión en el componente lento de la corriente con
rectificación tardía (IKs), mayor densidad en el componente tardío de la
corriente de sodio (INa tardía), y mayor densidad en la corriente aportada por
el intercambiador sodio-calcio (INa-Ca)3.
Existen diferencias interventriculares entre las células M
que determinan que
Efectos de la isquemia
miocárdica aguda sobre el PA cardíaco
·
Disminución del potencial de
membrana en reposo.
Esto significa que la fase 4 del potencial de membrana se establece a niveles
menos negativos. La base para este efecto es la concentración incrementada de
potasio, que ocurre en el medio extracelular que circunda las células isquémicas.
Se conoce desde hace décadas, que el aumento de los niveles del potasio
extracelular despolariza parcialmente a las células musculares del corazón.
·
Disminución en la velocidad de
ascenso en la fase 0 (Vmax) del PA. Esta consecuencia de la isquemia aguda se produce por una
menor disponibilidad de canales de sodio listos para activarse. Se mencionó anteriormente
que la célula isquémica está parcialmente despolarizada, como la apertura de
canales de sodio es en parte, dependiente del voltaje de reposo en la membrana (Fig
2) y este es menos negativo, dicho efecto condiciona que una cantidad finita de
la población de canales de sodio estén en estado de inactivación, no
disponibles. Uno de los determinantes de
|
|
|
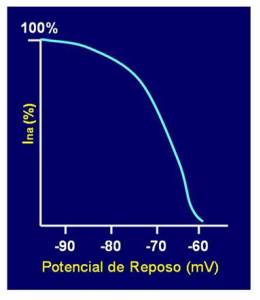
Fig 2
Curva clásica de disponibilidad de corriente de sodio a distintos niveles del
potencial de membrana en reposo. Se aprecia que aproximadamente a -60mV la
cantidad de INa es cero. |
·
Disminución en la amplitud del PA. Esto es consecuencia directa de la
menor disponibilidad de canales de sodio por la despolarización parcial de la
membrana con un pico de corriente menor resultante, en estas células existirá
lógicamente, una menor magnitud en la fase 0.
·
Acortamiento en la duración total
del PA. Es un
efecto directo de la actuación de un tipo de corriente repolarizante que no está
disponible en condiciones fisiológicas. Se refiere a la corriente de potasio
dependiente de ATP (IKATP) que se manifiesta cuando la
disponibilidad de dicha molécula energética disminuye, como sucede en la
isquemia aguda.
Elevación primaria del
segmento ST y el punto J en humanos normales
Cuando se habla de los efectos que la isquemia aguda produce
en el miocardio ventricular, sin otros elementos de ayuda, es difícil que el lector
se de cuenta de las consecuencias electrocardiográficas de este hecho. Se debe
comenzar diciendo que existe el acuerdo mayoritario entre los
electrocardiografistas de que los cambios del electrocardiograma clínico, se
explican principalmente por la teoría del ángulo sólido. Más que registrar
campos de corriente formados por un dipolo que se aleja de un electrodo
explorador dado, lo que documenta el electrocardiógrafo son los flujos de
corrientes que se crean (en este caso se refiere a los sucesos que ocurren a
partir del punto J), producto de la heterogeneidad de la repolarización
principalmente transmural, que se manifiesta por debajo de la esfera teórica y
constituye el electrodo de registro.
La heterogeneidad eléctrica transmural que está presente en
la fase 1 de algunos humanos normales puede llegar a ser de tal significación
que dé origen a una corriente dirigida de endocardio a epicardio, que se
expresa en el electrocardiograma como una elevación del punto J, que puede ser
de hasta 0.5 mV. Esto a menudo se acompaña de una elevación
cóncava del segmento ST, y suele aparecer en varones jóvenes de piel oscura
(sujetos melanóticos). A veces, el punto J elevado deja de ser tal punto para
convertirse en una especie de melladura o empastamiento en las fuerzas finales
del QRS, otras veces adopta el aspecto de un enlentecimiento final como de
pseudodelta tardía, y existen electrocardiogramas que muestran una onda de baja
amplitud y corta duración bien conformada, que es lo que en este caso
llamaremos onda J. También conocido como síndrome o patrón de repolarización
precoz10-13 (Fig 3).
|
|
|
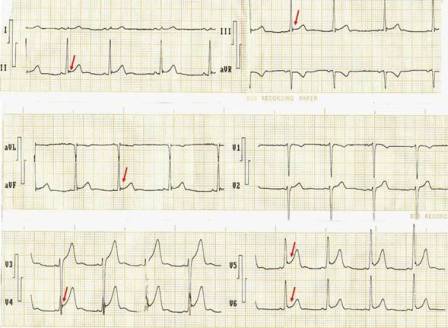
Fig 3
Electrocardiograma con patrón de repolarización precoz realizado a un varón
joven, saludable y mestizo, de 19 años de edad durante una pesquisa de
rutina. Las flechas señalan la presencia de onda J con distintos aspectos
morfológicos. Apréciese la clásica elevación cóncava del segmento ST en
derivaciones inferiores y precordiales izquierdas. |
Sin embargo, muchas personas normales tienen un punto J y un
segmento ST isoeléctrico, y esto se debe a que aunque presenten la
heterogeneidad eléctrica transmural, que fisiológicamente todos poseemos, esta
no tiene la suficiente magnitud para generar flujos de corriente con suficiente
potencia para expresarse en el electrocardiograma clínico.
Como preámbulo ya se conoce que la heterogeneidad eléctrica
normal transmural existe en todos los humanos normales, y que es suficiente en
algunos casos para producir una elevación primaria y espontánea del segmento ST,
de ahí que este hecho fisiológico constituya el motor impulsor del
supradesnivel del segmento ST que aparece en el IAM.
El por qué de la
elevación del segmento ST durante el IAM
Cuando se ocluye una arteria epicárdica ocurre isquemia de una
determinada masa muscular ventricular con una afectación transmural. Es común
que todos tengamos en mente que la región más afectada sea la del subendocardio,
por las características de su irrigación, y porque soporta el mayor estrés
parietal, que es el determinante más importante del consumo miocárdico de oxígeno.
Conociendo esto, es lógico que muchos piensen que los efectos que la isquemia
aguda produce sobre el PA (explicados con anterioridad) se manifiesten a
plenitud en las células, con mayor sufrimiento hipóxico. Si esto fuera así el IAM,
en vez de producir una elevación primaria del ST, generaría un infradesnivel de
este.
El electrocardiógrafo registra los campos eléctricos
extracelulares. Si se conoce lo que ocurre en cada fase del PA de una célula
isquémica, al tener como patrón a una célula normal o con menor afectación electrofisiológica
por la isquemia aguda, comprenderemos que las células con mayor alteración eléctrica
(epicárdicas) tendrán un ambiente extracelular más electropositivo que su
contrapartida o células del endocardio (ambiente exterior electronegativo
respecto a las células del epicardio).
Por convención se acepta que los vectores de corriente se
dirigen desde regiones más electronegativas a las más electropositivas, lo que
crea un flujo de corriente con dirección de endocardio a epicardio, o dicho más
sencillo, de abajo hacia arriba.
En la superficie del tórax estaría el electrodo explorador,
que está diseñado para que toda corriente que a él se acerque sea inscrita como
deflexión positiva, en este caso nos referimos al punto J y el segmento ST (Fig
4).
|
|
|
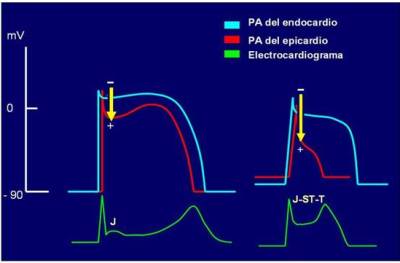
Fig 4
Representación didáctica de las bases vectoriales de la elevación del punto J
y el segmento ST en el patrón de repolarización precoz, y el infarto agudo
del miocardio. El tamaño de la flecha significa la magnitud del vector
dirigido de endocardio a epicardio y los signos positivo (+) y negativo (–),
representan polaridades de cargas extracelulares. |
Susceptibilidad
eléctrica del epicardio frente a la isquemia aguda
A pesar del mayor sufrimiento hipóxico de las células endocárdicas,
el epicardio está sujeto a una mayor depresión eléctrica. La presencia de una
corriente ITO prominente que ya fisiológicamente está presente, es
responsable de gran parte de este efecto. Una exacerbación en la densidad de
esta corriente inducida por la isquemia aguda acrecienta la espiga del PA a tal
punto que se pierda su domo. Al no ocurrir esto de forma homogénea en el
epicardio isquémico se condiciona la ocurrencia de reentrada de fase 2, como un
mecanismo de arritmias en la fase aguda del infarto.
Para apoyar el importante papel de ITO epicárdica
en esta circunstancia, recordemos que la mujer con enfermedad coronaria tiene
solo un cuarto de riesgo de muerte cardíaca súbita con respecto al hombre, lo
cual en parte es debido, a que ITO es más prominente en el hombre
que en la mujer14. Además
de la importancia de ITO en crear la heterogeneidad eléctrica
necesaria para la elevación del segmento ST durante el IAM, y su contribución
en la arritmogénesis durante su fase más aguda, se ha demostrado una mayor
sensibilidad del epicardio isquémico en la activación de la corriente IKATP,
lo que sugiere que este efecto (acortador de
Recientemente se comprobó que no solo estarían implicadas
las corrientes ITO e IKATP para explicar la mayor
susceptibilidad ante la alteración electrofisiológica del epicardio, el
componente rápido de la corriente de sodio (INa) también, debe ejercer su
influencia. Cordeiro et al15 observaron que el voltaje
medio de inactivacion de
En resumen, en condiciones fisiológicas existe un gradiente eléctrico
en las fases tempranas de la repolarización, que si es de suficiente magnitud
puede generar en algunos humanos normales, un patrón de repolarización precoz.
Dicha heterogeneidad normal, que favorece vectores de corriente dirigidos de
endocardio a epicardio, se exacerba durante un IAM y produce la clásica
elevación del ST. Las células del epicardio, aunque deben sufrir menos la
isquemia con respecto a las endocárdicas, poseen corrientes con respuesta
distinta frente a este suceso, lo que las vuelve más vulnerables y sensibles
desde el punto de vista eléctrico.
Referencias bibliográficas
1. Antzelevitch
C, Dumaine R. Electrical heterogeneity in the heart: Physiological,
pharmacological and clinical implications. In: Page E, Fozzard HA, Solaro RJ,
editors. Handbook of physiology. Section 2. The cardiovascular system. New
York: Oxford University Press; 2001. p. 654-92.
2. Antzelevitch
Ch, Fish J. Electrical heterogeneity within ventricular wall. Basic
Res Cardiol. 2001;96(6):517-27.
3.
Carmona RP, López BV, Pérez AA. En el corazón
normal no siempre se corresponden estructura microscópica y función. Medicentro
Electrónica [Internet]. 2007 Ene-Mar [citado 10
Sept 2010];11(1):[aprox. 4 p.]. Disponible en:
http://medicentro.vcl.sld.cu/paginas%20de%20acceso/Sumario/ano%202007/v11n1a07/corazon.htm
4. Birnbaum
SHG, Varga AW, Yuan Ll, Anderson AE, Sweatt JD, Schrader LA. Structure and
function of Kv 4-family transient potassium channels.
Physiol Rev. 2004;84(3):803-33. doi:10.1152/physrev.00039.2003
5.
Carmona Puerta R. Síndrome de Brugada: desde los genes hasta la
terapéutica. Corsalud 2010 [serial online] [citada 10 Sept 2010];2(2): 145-61: [2 p.]. Disponible en:
http://corsalud.vcl.sld.cu/sumario/2010/v2n2a10/sindromebrugada.htm
6. Antzelevitch
C, Oliva A. Amplification of spatial dispersion of repolarization underlies
sudden cardiac death associated with catecholaminergic polimorphic VT, long QT,
short QT and Brugada syndromes. J Intern Med. 2006;259(1):48-8.
7. Antzelevitch
C. Heterogeneity and cardiac arrhythmias: An overview. Heart Rhythm
2007;4(7):964-72.
8. Antzelevitch
C. Role of spatial dispersion of repolarization in inhereted and acquired
sudden cardiac death syndromes. Am J Physiol Heart Circ Physiol. 2007; 293(4):2024-38.
9. Antzelevitch
C. Cardiac repolarization. The long and short of it. Europace. 2005 Sep;7 Suppl
2:3-9.
10. Wellens
HJ. Early repolarization revisited. N Engl J Med. 2008;358(19):2063-4.
11. Riera
AR, Uchida AH, Schapachnik E, Dubner S, Zhang L, Ferreira C. Early
repolarization variant: epidemiological aspects, mechanism, and differential
diagnosis. Cardiol J. 2008;15(1):4-16.
12. Boineau
JP. The early repolarization variant-normal or a marker of
heart disease in certain subjects. J Electrocardiol. 2007;40(1):3.e11-6.
13. Boineau
JP. The early repolarization variant-an
electrocardiographic enigma with both QRS and J-ST-T anomalies. J Electrocardiol.
2007;40(1):3.e1-10.
14. Antzelevitch
C, Yan GX. J wave syndromes. Heart Rhythm. 2010;7(4):549-58.
15. Cordeiro
JM, Mazza M, Goodrow R, Ulahannan N, Antzelevitch C, Di Diego JM. Functionally
distinct sodium channels in ventricular epicardial and endocardial cells
contribute to a greater sensitivity of the epicardium to electrical depression.
Am J Physiol Heart Circ Physiol. 2008;295(1):H154-62.
Recibido: 12 de septiembre de 2010
Aceptado
para su publicación: 29 de septiembre de 2010