CorSalud
2010;2(1)
INSTITUTO
DE CARDIOLOGÍA Y CIRUGÍA CARDIOVASCULAR
CIUDAD DE
ARTÍCULO
ESPECIAL
SIGNOS ELÉCTRICOS PREMONITORIOS DE RIESGO: ¿CUÁL ES EL MEJOR? CONTROVERSIA
NO TERMINADA, EN IMPETUOSO CRECIMIENTO
Por:
Dra. Margarita
Dorantes Sánchez
______________
Especialista
de II Grado en Cardiología del Servicio de Arritmias y Estimulación Cardíaca. Profesora
Consultante. Investigadora Titular. e-mail: dorantes@infomed.sld.cu
|
Palabras clave: SIGNOS
ELECTRICOS PREMONITORIOS ARRITMIAS
VENTRICULARES MALIGNAS ESTRATIFICACION
DE RIESGO |
Key
words: Electrocardiographic
risk markers MALIGNANT
VENTRICULAR ARRHYTHMIAS RISK
STRATIFICATION |
La identificación de signos eléctricos premonitorios que
permitan estratificar el riesgo de las arritmias ventriculares malignas o de
sus recidivas, es uno de los mayores retos a los que se enfrenta la comunidad
cardiológica internacional. Ello explica la profusión de publicaciones sobre el
tema, el surgimiento de muchos predictores nuevos y el renacimiento de otros,
que habían sido olvidados e incluso despreciados. Es un terreno de continuo
análisis y controversias que no terminan, lo cual se explica por ser un
problema aún no resuelto1-18.
A ello contribuye la propia complejidad de estas
arritmias, en las que intervienen procesos tan diversos como: factores
dinámicos (restitución de la duración del potencial de acción y de la velocidad
de conducción, memoria a corto plazo, corrientes electrotónicas, dinámica en el
retículo sarcoplasmático), que transitan entre la estabilidad y la
inestabilidad. Y de otro lado, la heterogeneidad de los tejidos (menor o
mayor): homogeneidad, isotropía, anisotropía, gradientes de potencial de
acción, remodelación estructural (fibrosis, infarto), eléctrica (hipertrofia, miocardiopatía) y neurológica, y defectos genéticos
(canalopatías, miocardiopatías)19.
De la interacción entre los factores dinámicos y la
heterogeneidad hística, dependerá el mayor o menor riesgo. De la interacción
entre la inestabilidad dinámica y la heterogeneidad de los tejidos, el paciente
se moverá del espectro de menor vulnerabilidad a la de mayor peligro19.
Ya se sabe que estas arritmias se producirán cuando todo
sea favorable en el triángulo: sustrato anátomo-funcional, sucesos transitorios
disparadores y mecanismos arritmogénicos esenciales.
Dentro de los signos premonitorios de riesgo de arritmias
malignas, ¿cuál es el mejor? Creemos que ninguno es absoluto, pero al mismo
tiempo, ninguno es despreciable ni debe ser olvidado. Todos son equívocos, y en
general, de bajo valor predictivo. En la actualidad se retoman algunos antiguos,
olvidados, que hoy renacen, y se describen nuevos12,13, 16-18.
Para descubrirlos debe seguirse el rastro de las secuencias
eléctricas, pues muchos son inconstantes, mínimos, frustres u ocultos a la
vista.
Por otra parte, hay signos eléctricos que se encuentran
entre la inocencia y la culpabilidad, y uno se pregunta, si en un paciente dado
son benignos o expresan potencialidad arritmogénica8-11,20.
No existen marcadores definitivos para estratificar el riesgo,
sólo permiten un acercamiento a la realidad. Los signos eléctricos
premonitorios son buenos para identificar grandes grupos en riesgo pero no lo
son para, dentro de ese gran grupo, identificar individuos en riesgo.
Resulta importante acercarse, en parte, a la población
con mayor riesgo de arritmias malignas o de recidivas, mediante mediciones
asequibles y reproducibles, para tomar las medidas adecuadas.
Resulta relativamente sencillo buscar, en un paciente
reanimado de un episodio de muerte súbita, los signos eléctricos premonitorios
en trazados anteriores o posteriores a este suceso. Pero lo contrario, ir de
los signos a los posibles pacientes que puedan presentar muerte súbita o arritmia
ventricular maligna, es sumamente difícil y con frecuencia imposible.
Ni en el laboratorio, con estudios complejos e invasivos, como la estimulación eléctrica programada,
existen marcadores definitivos para estratificar el riesgo.
Debemos cobrar conciencia de la importancia capital de
los trazados eléctricos periféricos para descubrir estas alteraciones, y la
trascendencia del análisis cuidadoso de la historia eléctrica del paciente.
Procedimiento sencillo, a la mano, reproducible.
Algunos de estos signos son: extrasístoles ventriculares,
taquicardia ventricular no sostenida, signo eléctrico de Brugada,
signos de preexcitación ventricular, dispersión de la repolarización
ventricular, depresión del vago y de la variabilidad de la frecuencia cardíaca,
alternancia de la onda T, nodo hiperconductor, intervalos QT largo y corto,
bradicardia y taquicardia sinusales, intervalo PR prolongado, bloqueo de rama,
trastornos de la conducción auriculoventricular, bloqueo sinoauricular, paro
sinusal, bajo o alto voltaje del complejo QRS, alteraciones del segmento ST, QT
paradójico, hipertrofia ventricular izquierda, turbulencia de la frecuencia
cardíaca ventricular (descrita en 1999, como la ausencia de 15 ciclos después
de una extrasístole con la frecuencia aumentada para luego disminuir), ondas J,
T, T1 T2, U, épsilon, presencia de potenciales tardíos, signo de repolarización
precoz, fibrilación auricular, memoria eléctrica, T pico-T final, discordancia
TU (menos-más, más-menos, menos-menos), distorsión terminal del QRS, conducción
en zig-zag en espigas del
QRS como predictor de arritmias ventriculares malignas en pacientes coronarios
(sin bloqueo de rama), disincronía auriculoventricular e intraventricular2-11,12-15,20. Ver figuras
1-4 que muestran ejemplos de signos premonitorios en pacientes de nuestro
servicio que han sufrido arritmias ventriculares malignas.
|
|
|
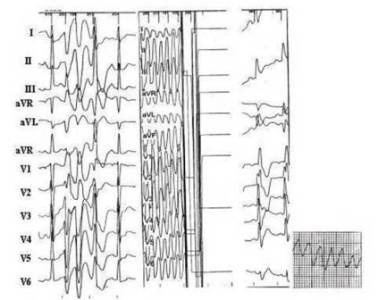
Fig 1 Paciente
joven sin enfermedad cardíaca estructural demostrable, reanimado
de un episodio de muerte súbita por fibrilación ventricular. A la izquierda,
trazado basal normal. Al centro, extrasístole ventricular con muy corto
intervalo de acoplamiento que provoca respuestas ventriculares repetitivas y
episodio de fibrilación ventricular (véase trazo electrocardiográfico en la
extrema derecha). Al centro, fibrilación ventricular provocada en el
laboratorio durante la implantación del cardioversor desfibrilador
automático, que tras un choque hace cesar la arritmia. |
|
|
|
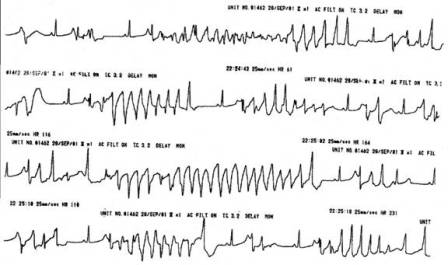
Fig 2 Paciente de 9 años de edad,
con corazón sano, reanimada de varios episodios de muerte súbita, con
síndrome de QT largo. Episodios de torsión de puntas y de fibrilación
ventricular. Se implantó marcapasos y se administraron betabloqueadores. |
|
|
|
Fig 3 Extrasístole ventricular
con intervalo corto de acoplamiento que provoca torsión de puntas. |
|
|
|
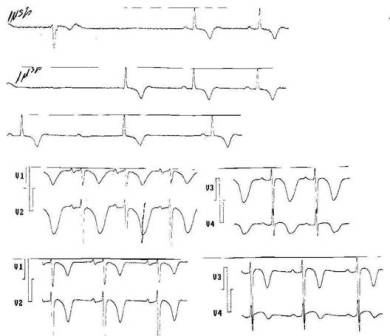
Fig 4 Solapamiento de
canalopatías: intervalo QT largo transitorio, disfunción sinusal, trastorno
auriculoventricular. Asistolia y complejos de escape. |
Algunos signos fueron olvidados durante un tiempo. El gradiente
espacial QRS-T de Wilson, descrito en 1930 y con un rescate reciente, cifras
normales de 0-105 grados, divergente de
Surgen otros nuevos como el síndrome de la onda J, que
incluye el síndrome de Brugada, fibrilación ventricular
idiopática, muerte súbita nocturna inexplicada y repolarización ventricular
precoz (por alteraciones en la corriente Ito)9-11,20.
El síndrome del canal de sodio, comprende el de Brugada, el de Lev-Lenegre, y el
QT largo tipo 3. La onda T constituye una ventana a la repolarización. En el
2008 se describió el aumento del punto J en derivaciones DI y aVL como signo premonitorio e índice de riesgo arrítmico de
la fibrilación ventricular idiopática9-11,20,
considerado antes como algo inocente.
Son premonitorios de arritmia ventricular maligna en el
síndrome de Brugada y sustrato de fibrilación
ventricular: la disincronía ventricular, el QRS de mayor duración, la
fragmentación del QRS, la onda R prominente en aVR y
el electrocardiograma tipo Brugada provocado por
inductores2-7. Habrá que
reconsiderar la repolarización precoz, conocida desde hace 60 años y con un
millón de citas en Google. El hallazgo inocente es
común, el infortunado es raro ¿Es benigno o es arritmogénico?
Se le encuentra en el 31 % de los casos con fibrilación ventricular idiopática
frente al 5 % en el grupo control y existen diversos modelos. También pueden observarse
el empastamiento o muesca, la joroba entre el final
del QRS y el segmento ST ¿Habrá que tener miedo a la onda J? Su localización es
diversa, y pueden verse cambios en su anchura y alteración, transitoriedad,
elevación del ST, T negativa y menor anchura del QRS y del QT en derivaciones inferolaterales. Deben excluirse los síndromes de Brugada, de QT largo y corto y la displasia arritmogénica del ventrículo derecho ¿Se trata de una
repolarización precoz o de una activación retardada?8-11,20.
Si aumenta la onda J, lo hará la activación ectópica ventricular del área J y habrá tendencia a la
taquicardia ventricular. Como opciones terapéuticas se cuenta con: el
cardioversor-desfibrilador automático implantable, la
quinidina y la ablación del área ectópica.
Otros signos novedosos son:
La gran conclusión, a la que no querríamos llegar: los
signos eléctricos premonitorios son buenos para identificar grandes grupos de
riesgo pero no lo son igualmente para, dentro de ese grupo, predecir el riesgo
individual.
Referencias bibliográficas
1.
Gallagher
MM, Padula M, Sgueglia M, Santini L, Voci P, Mahon NG, et al.
Electrocardiographic markers of structural heart disease and predictors of
death in 2332 unselected patients undergoing outpatient Holter recording.
Europace. 2007;9:1203-8.
2.
Junttila
MJ, González M, Lizotte E, Benito B, Vernooy K, Sarkozy A, et al. Induced
Brugada-type electrocardiogram, a sign for imminent malignant arrhythmias.
Circulation. 2008;117:1890-3.
3.
Viskin
S. Brugada syndrome in children. Don't ask, don't tell?. Circulation. 2007;115:1970-2.
4.
Priori
SG, Napolitano C, Gasparini M, Pappone C, Bella PD, Giordano U, et al. Natural
history of Brugada syndrome. Insights for risk stratification and management. Circulation.
2002;105:1342-7.
5.
Morita
H, Kusano KF, Miura D, Nagase S, Nakamura K, Morita ST, et al. Fragmented QRS
as a marker of conduction abnormality and a predictor of prognosis of Brugada
syndrome. Circulation. 2008;118:1697-704.
6.
Kaufman
ES, Rosenbaum DS. How to find the high-risk patient among individuals with a
Brugada syndrome-type electrocardiogram. J Cardiovasc Electrophysiol. 2005;16:52-3.
7.
Ajiro
Y, Hagiwara N, Kasanuki H. Assessment of markers for identifying patients at
risk for life-threatening arrhythmic events in Brugada syndrome. J Cardiovasc
Electrophysiol. 2005;16:45-51.
8.
Wellens
HJ. Early repolarization revisited. N Engl J Med. 2008;358:2063-5.
9.
Rosso
R, Kogan E, Belhassen B, Rozovski U, Scheinman MM, Zeltser D, et al. J-point
elevation in survivors of primary fibrillation and matched control subjects
incidence and clinical significance. J Am Coll Cardiol. 2008;52:1231-8.
10. Malik M. Repolarization morphology in
standard short-term electrocardiogram and cardiac risk stratification. Heart
Rhythm. 2005;2:79-81.
11. Haissaguerre M, Derval N, Sacher F, Jesel
L, Deisenhofer I, de Roy L, et al.
Sudden cardiac arrest associated with early repolarization. New Eng J Med.
2008;358:2016-23.
12. Yamazaki T, Froelicher VF, Myers J, Chun
S, Wang P. Spatial QRS-T angle predicts cardiac death in a clinical population.
Heart Rhythm. 2005; 2:73-8.
13. Batchvarov VN, Camm AJ. Postextrasystolic
changes in the complexity of the QRS complex and T wave. Ann Noninvasive
Electrocardiol. 2008;13:421-5.
14. Gettes LS. The T wave: "only the shadow
knows". Heart Rhythm. 2009;6:1209-10.
15. Rosenbaum DS. T-wave alternans in the
sudden cardiac death in heart failure trial population. Signal or noise?
Circulation. 2008;118:2015-8.
16. Wolpert C, Veltmann C, Schimpf R,
Antzelevitch C, Gussak I, Borggrefe M. Is a narrow and tall QRS complex an
electrocardiogram marker for sudden death? Heart Rhythm. 2008;5:1339-45.
17. Anttonen O, Junttila MJ, Maury P, Schimpf
R, Wolpert C, Borggrefe M, et al. Differences in twelve-lead electrocardiogram
between symptomatic and asymptomatic subjects with short QT interval. Heart
Rhythm. 2009;6:267-71.
18. Kirchhof P, Franz M, Bardai A, Wilde A.
Giant T-U waves precede torsades de pointes in long QT syndrome. A systematic
electrocardiographic analysis in patients with acquired and congenital QT
prolongation. J Am Coll Cardiol. 2009;54:143-9.
19. Weiss JN, Qu Z, Chen PS, Lin SF,
Karagueuzian HS, Hayashi H, et al. The dynamics of cardiac fibrillation.
Circulation. 2005;112:1232-40.
20. Viskin S. Idiopathic ventricular
fibrillation "Le syndrome
d'Haissaguerre" and the fear of J waves. J Am Coll Cardiol. 2009;53:620-2.